Bezpłatne materiały - filmy z rozwiązaniami zadań i nie tylko...
Poniżej znajdziesz linki do dostępnych nieodpłatnie materiałów edukacyjnych, jakie znajdują się na platformie PALLADIUM.
Ponadto zapraszam Cię również do odwiedzania naszych mediów społecznościowych:
TikTok: @chemia_z_palladium
Instagram: @chemia_z_palladium
Threads: @chemia_z_palladium
Facebook: @chemiazpalladium
Grupa na Facebooku: https://www.facebook.com/groups/chemiazpalladium
YouTube: @chemiazpalladium
Struktura cząsteczki związku organicznego a temperatura wrzenia (CAŁA LEKCJA) TEMAT VI. Wykład: termodynamika oraz statyka reakcji chemicznych, część 3 – równowagi chemiczne, reguła przekory (FRAGMENT LEKCJI) TEMAT VIII. Wykład: procesy redoks, część 1 – reakcje redoks, bilans jonowo-elektronowy (FRAGMENT LEKCJI) TEMAT X. Wykład: węglowodory, część 1 – alkany oraz cykloalkany, węglowodory nasycone (FRAGMENT LEKCJI) TEMAT XIII. Wykład: aldehydy i ketony (FRAGMENT LEKCJI) Jak rozpoznać typ oraz mechanizm reakcji chemicznej? Masa chlorku wapnia zawierająca tyle samo drobin, co masa innego związku chemicznego Obliczanie ciśnienia mieszaniny poreakcyjnej po zmianie objętości w stałej temperaturze Ustalanie wzoru empirycznego siarczku na podstawie stosunku wagowego pierwiastków Ustalanie wzoru sumarycznego tlenku manganu na podstawie danych ilościowych reagentów Ustalanie wzoru elementarnego i rzeczywistego węglowodoru z wykorzystaniem płuczki do gazów Obliczanie objętości zużytego wodoru podczas redukcji magnetytu Obliczanie stopnia przereagowania nadmiarowego substratu reakcji karbidu z wodą (wydajność reakcji) Obliczanie objętości mieszaniny gazów niezbędnej do reakcji z określoną masą magnezu Obliczanie niezbędnej ilości substratu użytego w wieloetapowym procesie (wydajność reakcji) Obliczanie zawartości pierwiastka w mieszaninie związków chemicznych Ustalanie procentowego składu wagowego stopu monety zbudowanej z cynku, miedzi oraz manganu Ocena poprawności zdań dotyczących dwuskładnikowego układu ciecz-para Określanie ułamka molowego tlenku węgla(II) w mieszaninie uzyskanej podczas syntezy gazu syntezowego Obliczanie bezwzględnej masy cząsteczki tlenu zbudowanej z dwóch różnych izotopów Obliczanie określonej masy radioizotopu z wykorzystaniem czasu połowicznej przemiany astatu-219 Ustalanie wzoru sumarycznego wodorku pierwiastka chemicznego oraz tlenku innego pierwiastka Wyjaśnienie, dlaczego druga energia jonizacji potasu jest większa niż druga energia jonizacji wapnia Analiza budowy cząsteczki ketonu Określanie relacji matematycznych między wartościami momentów dipolowych cząsteczek Ustalanie wzoru sumarycznego wodorku niemetalu o kątowej budowie cząsteczek Ustalanie wzoru sumarycznego kwasowego wodorku na podstawie wartości gęstości względnej Ocena poprawności stwierdzeń dotyczących doświadczenia z udziałem suchego lodu Otrzymywanie trudno rozpuszczalnego wodorotlenku ze związku kompleksowego oraz jego roztwarzanie Zapis obserwacji w zlewce podczas częściowego rozkładu węglanu berylu Zapis równań reakcji chemicznych prowadzących do uzyskania zanieczyszczonego siarkowodoru Obliczanie składu ilościowego mieszaniny użytej do reakcji Obliczanie stałej równowagi reakcji odwrotnej do syntezy metanolu Obliczanie mas substratów użytych w reakcji tworzenia cyjanowodoru Obliczanie entalpii wieloetapowego procesu podczas otrzymywania tlenku siarki(VI) Obliczanie czasu, po którym przereagowało 25% początkowej liczby anionów fenoloftaleinianowych Obliczanie krotności zmiany szybkości reakcji w wyniku przereagowania określonej ilości substratów Obliczanie minimalnego stężenia molowego tlenku siarki(VI) w oleum o określonej gęstości Obliczanie procentowego składu wagowego strąconego osadu soli srebra Określanie, czy strąci się osad substancji trudno rozpuszczalnej (iloczyn rozpuszczalności) Obliczanie procentu niezdysocjowanych cząsteczek kwasu HX Obliczanie wartości pH roztworu kwasu chlorowego(III) na podstawie liczby jonów chloranowych(III) Obliczanie stężenia roztworu w odniesieniu do wartości stopnia dysocjacji innej substancji Ocena poprawności zdań na podstawie wykresów zależności pH od stężenia roztworu Obliczanie zmiany stopnia dysocjacji w wyniku rozcieńczenia roztworu kwasu mlekowego Obliczanie pH roztworu kwasu solnego po rozcieńczeniu z uwzględnieniem autodysocjacji wody Obliczanie wartości pH roztworu buforu fosforanowego (bufory) Obliczanie zmiany masy blaszki do momentu 5-krotnego zmniejszenia się stężenia jonów srebra Obliczanie stałej równowagi reakcji przebiegającej w ogniwie cynkowo-kadmowym Obliczanie stężenia molowego kwasu w akumulatorze kwasowo-ołowiowym po częściowym jego rozładowaniu Obliczanie natężenia prądu, w celu przeprowadzenia procesu electroplatingu (elektroliza) Ustalanie wzoru grupowego oraz nazwy systematycznej alkenu Fizykochemiczne właściwości karbidu, ksylenu oraz naftalenu Określanie nazw alkoholi reagujących z wapniem według określonej stechiometrii Określanie wzoru rzeczywistego związku organicznego na podstawie przeprowadzonego doświadczenia Rysowanie wzoru półstrukturalnego izomeru cis retinalu Wybór związku chemicznego ulegającego kondensacji aldolowej Zapis równania reakcji chemicznej wydzielania gazu powodującego zmętnienie wody wapiennej Rysowanie brakującego fragmentu krzywej miareczkowania (miareczkowanie konduktometryczne) Przypisywanie liczby zmydlenia do określonego tłuszczu wraz z uzasadnieniem Ocena poprawności stwierdzeń dotyczących trzech amin Ustalanie wzoru sumarycznego oraz wzorów półstrukturalnych izomerycznych amidów Zapis równania reakcji chemicznej aminolizy estru Ustalanie sekwencji aminokwasów w peptydzie poddanym hydrolizie enzymatycznej Obliczanie zawartości selenu w ppm, w kapsułce suplementu diety Ocena poprawności zdań dotyczących czterech monosacharydów Ocena poprawności zdań dotyczących laktozy oraz celobiozy Obliczanie stężeń równowagowych podczas procesu mutarotacji glukozy Zapis wzorów sumarycznych związków chemicznych na podstawie fotografii oraz opisu doświadczenia Chemia – podstawa programowa obowiązująca na maturze od 2025 roku (formuła 2023) Usuwanie przemijającej twardości wody oraz składniki powstającego kamienia kotłowego Czy tlenki kwasowe (nie)reagują z kwasami? Zmiany pierwszej energii jonizacji wśród pierwiastków – analiza w bloku s oraz bloku p Jakiego kalkulatora można używać na maturze z chemii? Wzór strukturalny, grupowy (półstrukturalny) oraz szkieletowy (uproszczony) i matura z chemii Stosunek masowy oraz molowy składników mieszaniny – przeliczanie Jak odczytywać dane z wykresów mających podziałkę logarytmiczną? Podstawowe wzory do obliczeń chemicznych Substytucja rodnikowa w mniej niż pięć minut Drewno, celuloza i wiązania wodorowe Dlaczego łyżwiarz ślizga się po lodzie? Czyli diagram fazowy wody w praktyce Zmiana ciśnienia w reakcjach równowagowych, biegnących z udziałem reagentów gazowych Sporządzanie roztworów metodą kolejnych rozcieńczeń Podobne (nie)zawsze rozpuszcza podobne Bilans jonowo-elektronowy bez wykorzystania wartości stopni utlenienia pierwiastków chemicznych Dziesięć zagadnień z chemii organicznej, których zrozumienie uratuje Twój wynik Zależność między stopniem dysocjacji i wartością wyrażenia Co/K Płatek śniegu i wiązania wodorowe Przygotowanie roztworu o określonym stężeniu procentowym, molowym oraz masowym Zrób to sam – octan miedzi(II). Opis doświadczenia oraz jego fizykochemiczna analiza Antymon i Tatry, czyli chemia w otaczającej nas przyrodzie Obserwacje podczas przebiegu doświadczeń chemicznych Miareczkowanie alkacymetryczne Hierarchia grup funkcyjnych w związkach organicznych Określanie ważności podstawników w izomerii geometrycznej oraz optycznej Para enancjomerów, czy ta sama cząsteczka? Równowagi jonowe z udziałem wodorotlenku cynku Przypisywanie wartości stopni utlenienia pierwiastkom w związkach organicznych Kilka zastosowań płuczki do gazów Utlenianie toluenu za pomocą manganianu(VII) potasu w środowisku kwasowym oraz obojętnym Wpływ pH środowiska na przebieg reakcji redoks z udziałem jonów manganianowych(VII) Cząsteczka polarna, czy niepolarna? Które atomy leżą wzdłuż tej samej linii, a które na tej samej płaszczyźnie? Szczęśliwa trzynastka, czyli jak uczyć się lepiej, szybciej i przyjemniej? Wzory szeregów homologicznych związków organicznych Wykłady z teorią
Tutoriale
Rozwiązania zadań krok po kroku (STECHIOMETRIA I MIESZANINY)
Rozwiązania zadań krok po kroku (ATOM I CZĄSTECZKA, UKŁAD OKRESOWY)
Rozwiązania zadań krok po kroku (PIERWIASTKI BLOKÓW s ORAZ p)
Rozwiązania zadań krok po kroku (KINETYKA, STATYKA I EFEKTY ENERGETYCZNE)
Rozwiązania zadań krok po kroku (STĘŻENIA I ROZPUSZCZALNOŚĆ, ILOCZYN ROZPUSZCZALNOŚCI)
Rozwiązania zadań krok po kroku (STOPIEŃ DYSOCJACJI, pH, HYDROLIZA, BUFORY, MIARECZKOWANIE)
Rozwiązania zadań krok po kroku (REAKCJE REDOKS, PIERWIASTKI BLOKU d, ELEKTROCHEMIA)
Rozwiązania zadań krok po kroku (CHEMIA ORGANICZNA)
Rozwiązania zadań krok po kroku (ZADANIA Z FOTOGRAFIAMI ODCZYNNIKÓW oraz PIKTOGRAMAMI)
Rozwiązania zadań krok po kroku (ARKUSZE CKE)
Artykuły edukacyjne
Określanie symboli pierwiastków chemicznych, ich elektronów walencyjnych oraz bloku energetycznego. Zadanie 1.1. Arkusz CKE chemia maj 2025 rozszerzony (2 punkty)
O dwóch pierwiastkach umownie oznaczonych literami E i X wiadomo, że:
• elektrony atomu E w stanie podstawowym zajmują osiem orbitali, przy czym sześć z nich jest całkowicie zapełnionych
• konfigurację elektronową atomu X w jednym ze stanów wzbudzonych przedstawia poniższy zapis.
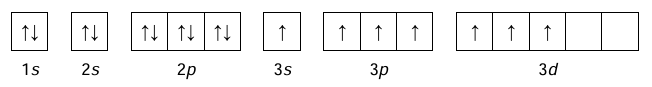
Uzupełnij tabelę. Napisz symbole pierwiastków E i X, symbol bloku konfiguracyjnego, do którego należy każdy z pierwiastków, oraz podaj sumaryczną liczbę elektronów w podpowłokach walencyjnych.
Przypisywanie wartości liczb kwantowych. Zadanie 1.2. Arkusz CKE chemia maj 2025 rozszerzony (1 punkt)
O dwóch pierwiastkach umownie oznaczonych literami E i X wiadomo, że:
• elektrony atomu E w stanie podstawowym zajmują osiem orbitali, przy czym sześć z nich jest całkowicie zapełnionych
• konfigurację elektronową atomu X w jednym ze stanów wzbudzonych przedstawia poniższy zapis.

Uzupełnij tabelę. Napisz wartości dwóch liczb kwantowych: głównej i pobocznej, które opisują stan kwantowy jednego z niesparowanych elektronów atomu E w stanie podstawowym.
Zapis pełnej konfiguracji podpowłokowej anionu. Zadanie 1.3. Arkusz CKE chemia maj 2025 rozszerzony (1 punkt)
O dwóch pierwiastkach umownie oznaczonych literami E i X wiadomo, że:
• elektrony atomu E w stanie podstawowym zajmują osiem orbitali, przy czym sześć z nich jest całkowicie zapełnionych
• konfigurację elektronową atomu X w jednym ze stanów wzbudzonych przedstawia poniższy zapis.

Przedstaw pełną konfigurację elektronową jonu X– w stanie podstawowym. Zastosuj zapis konfiguracji elektronowej z uwzględnieniem podpowłok.
Uzupełnienie schematu reakcji rozszczepienia atomu uranu. Zadanie 2.1. Arkusz CKE chemia maj 2025 rozszerzony (1 punkt)
Niektóre ciężkie jądra ulegają reakcjom rozszczepienia. Takie jądra bombardowane neutronami ulegają podziałowi na dwa lżejsze fragmenty. Tej przemianie towarzyszy emisja dwóch lub trzech neutronów.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2018.
W jednej z reakcji rozszczepienia jąder 235U powstają 92Kr oraz 141Ba.
Uzupełnij schemat tak, aby otrzymać równanie opisanej przemiany, która prowadzi do powstania jąder kryptonu i baru.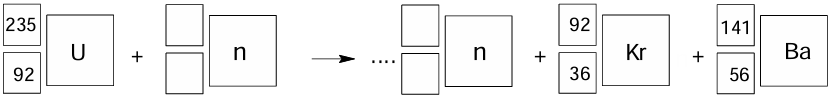
Wybór właściwych wyrażeń w nawiasach. Zadanie 2.2. Arkusz CKE chemia maj 2025 rozszerzony (1 punkt)
Niektóre ciężkie jądra ulegają reakcjom rozszczepienia. Takie jądra bombardowane neutronami ulegają podziałowi na dwa lżejsze fragmenty. Tej przemianie towarzyszy emisja dwóch lub trzech neutronów.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2018.
W jednej z reakcji rozszczepienia jąder 235U powstają 92Kr oraz 141Ba.
Uzupełnij zdania. Zaznacz jedną odpowiedź spośród podanych w każdym nawiasie. Jeżeli po pochłonięciu jednego neutronu przez jądro 235U następuje jego rozszczepienie, w wyniku którego powstaje jądro 93Sr i są emitowane 3 neutrony, to równocześnie tworzy się jądro ( 139I / 140Xe / 140Ba ). Wśród jąder biorących udział w tej przemianie większy stosunek liczby neutronów do liczby protonów ma jądro ( 235U / 93Sr ).
Zapis równania reakcji tlenku jodu(V) z wodą. Zadanie 3.1. Arkusz CKE chemia maj 2025 rozszerzony (1 punkt)
Jod tworzy wiele połączeń z tlenem np. tlenek jodu(V), który jest białym ciałem stałym. W reakcji tego związku z wodą powstaje jednoprotonowy kwas. Opisany tlenek jest stosowany do wykrywania i oznaczania zawartości tlenku węgla(II) w powietrzu.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2018.
Napisz w formie cząsteczkowej równanie opisanej reakcji tlenku jodu(V) z wodą.
Zapis równania reakcji tlenku jodu(V) z tlenkiem węgla(II). Zadanie 3.2. Arkusz CKE chemia maj 2025 rozszerzony (1 punkt)
Jod tworzy wiele połączeń z tlenem np. tlenek jodu(V), który jest białym ciałem stałym. W reakcji tego związku z wodą powstaje jednoprotonowy kwas. Opisany tlenek jest stosowany do wykrywania i oznaczania zawartości tlenku węgla(II) w powietrzu.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2018.
Przeprowadzono doświadczenie. W kolbie ustawionej pod wyciągiem umieszczono tlenek jodu(V), a następnie wprowadzono do niej tlenek węgla(II) i szczelnie ją zamknięto. Wygląd zawartości kolby, w której zachodzi reakcja utleniania-redukcji, przedstawiono na zdjęciu.

Napisz w formie cząsteczkowej równanie reakcji tlenku jodu(V) z tlenkiem węgla(II).
Ustalanie wzoru empirycznego oraz rzeczywistego tlenku jodu. Zadanie 4. Arkusz CKE chemia maj 2025 rozszerzony (2 punkty)
W jednym z tlenków jodu masa tlenu stanowi 20,14 % masy tego tlenku. W jego wzorze rzeczywistym liczba atomów jodu jest dwa razy większa niż we wzorze empirycznym.
Na podstawie obliczeń ustal i napisz wzór empiryczny oraz wzór rzeczywisty opisanego tlenku. Wzór empiryczny: Wzór rzeczywisty:
Zapis równania reakcji redukcji oraz uzupełnienie schematu reakcji. Zadanie 5.1. Arkusz CKE chemia maj 2025 rozszerzony (2 punkty)
W odpowiednich warunkach fluorowce mogą ze sobą reagować i tworzyć tzw. związki międzyhalogenowe o wzorze ogólnym AX𝑦, w którym 𝑦 przyjmuje wartość 1, 3, 5 lub 7. W tym wzorze A oznacza pierwiastek o mniejszej elektroujemności, a X – pierwiastek o większej elektroujemności. Przykładem związku międzyhalogenowego jest trichlorek jodu o wzorze ICl3.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2018.
Trichlorek jodu został po raz pierwszy otrzymany w reakcji, której schemat przedstawiono poniżej.
![]()
Napisz w formie jonowej, z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy), równanie reakcji redukcji zachodzącej podczas tej przemiany. Uwzględnij środowisko reakcji. Uzupełnij współczynniki stechiometryczne w poniższym schemacie. Równanie reakcji redukcji:
Rozstrzygnięcie z uzasadnieniem, w której probówce uzyskano osad wyłącznie tlenku metalu. Zadanie 6. Arkusz CKE chemia maj 2025 rozszerzony (1 punkt)
Uczniowie wykonali dwuetapowe doświadczenie, którego celem było otrzymanie czystego tlenku miedzi(II). W pierwszym etapie strącili wodorotlenek miedzi(II), a w drugim etapie przeprowadzili jego rozkład termiczny w łaźni wodnej. Następnie uzyskaną mieszaninę przesączyli, żeby wyodrębnić stały produkt.
Na poniższym schemacie przedstawiono pierwszy etap doświadczenia.
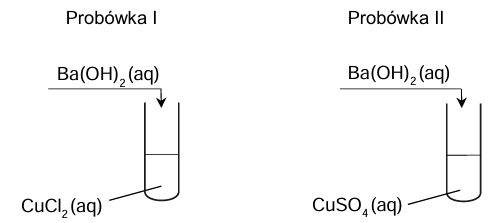
Rozstrzygnij, w której probówce (I czy II) otrzymano osad tylko tlenku metalu. Odpowiedź uzasadnij. Rozstrzygnięcie: Uzasadnienie:
Zapis wzorów sumarycznych odpowiednich wodorotlenków. Zadanie 7.1. Arkusz CKE chemia maj 2025 rozszerzony (1 punkt)
W probówkach oznaczonych numerami I–IV umieszczono oddzielnie, w przypadkowej kolejności, wodne roztwory soli różnych metali. Do probówek wprowadzono roztwór wodorotlenku sodu, w wyniku czego w każdej z nich pojawiła się zawiesina innego wodorotlenku:
Cr(OH)3 Ca(OH)2 Cu(OH)2 Al(OH)3
Zawiesiny otrzymane w probówkach I i II posłużyły do przeprowadzenia doświadczenia zgodnie ze schematem.
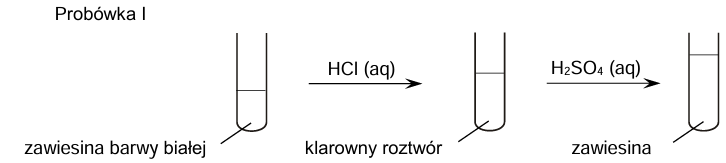
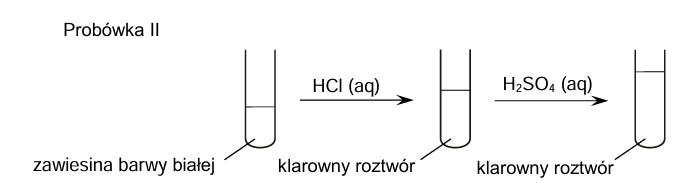
Uzupełnij tabelę. Spośród wodorotlenków wymienionych w informacji wstępnej wybierz te, których zawiesiny znajdowały się na początku doświadczenia w probówkach I i II. Napisz wzory tych związków.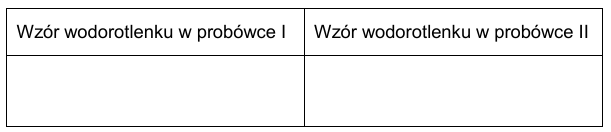
Zapis równań reakcji chemicznych. Zadanie 7.2. Arkusz CKE chemia maj 2025 rozszerzony (2 punkty)
W probówkach oznaczonych numerami I–IV umieszczono oddzielnie, w przypadkowej kolejności, wodne roztwory soli różnych metali. Do probówek wprowadzono roztwór wodorotlenku sodu, w wyniku czego w każdej z nich pojawiła się zawiesina innego wodorotlenku:
Cr(OH)3 Ca(OH)2 Cu(OH)2 Al(OH)3
Probówkę III umieszczono na pewien czas w łaźni wodnej.
Wygląd zawartości tej probówki po ogrzaniu przedstawiono na
zdjęciu A.
Do zawiesiny wodorotlenku znajdującego się w probówce IV
dodano roztwór wodorotlenku sodu – wygląd zawartości tej
probówki przedstawiono na zdjęciu B.

Napisz równania reakcji: • w formie cząsteczkowej – termicznego rozkładu wodorotlenku znajdującego się w probówce III (reakcja 1.) Reakcja 1.: Reakcja 2.:
• w formie jonowej skróconej – roztwarzania wodorotlenku znajdującego się w probówce IV (reakcja 2.).
Obliczanie jaka część KBr uległa reakcji chemicznej. Zadanie 8. Arkusz CKE chemia maj 2025 rozszerzony (2 punkty)
W celu otrzymania kwasu bromowodorowego przeprowadzono doświadczenie z użyciem zestawu, który zilustrowano rysunkiem obok. Do kolby stożkowej zawierającej 9,5 g czystego stałego bromku potasu wprowadzono kroplami pewną ilość stężonego kwasu siarkowego(VI). Zaszła reakcja opisana poniższym równaniem.
KBr + H2SO4 → KHSO4 + HBr
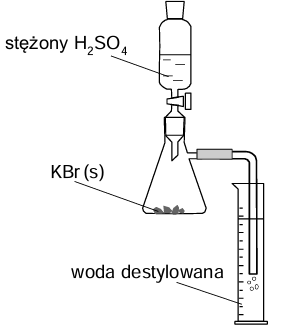
W wyniku całkowitego pochłonięcia wydzielonego bromowodoru otrzymano w cylindrze 80 cm3 kwasu bromowodorowego. Z tego roztworu pobrano próbkę 1,0 cm3, którą rozcieńczono wodą. Do jej zobojętnienia zużyto 6,9 cm3 roztworu wodorotlenku potasu o pH = 13.
Oblicz, jaka część użytego w doświadczeniu KBr uległa reakcji z H2SO4. Wynik podaj w procentach.