05.09.2019 | 2 komentarze

Hydroliza w wodnych roztworach soli to jedno z tych zagadnień, które wzbudza wiele emocji wśród uczniów. Mam nadzieję, że po zapoznaniu się z tym artykułem rozwieję większość (a może i wszystkie) Twoje wątpliwości związane z tym problemem.
Ogólnie rzecz biorąc sole dzielimy na obojętne, wodorosole oraz hydroksosole. W artykule skupimy się na określaniu odczynu roztworów wodnych dwóch pierwszych z wymienionych, przy czym będą to jedynie związki o budowie jonowej.
Sole obojętne można schematycznie przedstawić wzorem sumarycznym w postaci:
MaRb
gdzie: M – to kation metalu (lub jon amonowy) o wartości bezwzględnej ładunku b, natomiast R – anion reszty kwasowej (o wartości bezwzględnej ładunku a), która nie zawiera atomów wodoru, jakie mogłyby zostać oddysocjowane za pośrednictwem wody. Należy pamiętać, że określenie „sól obojętna” nie zawsze oznacza, że odczyn wodnego roztworu takiego związku chemicznego jest obojętny, ponieważ zależne jest to, czy w jego wodnym roztworze przebiega (lub nie) proces hydrolizy. Dane na temat możliwych odczynów wodnych roztworów soli zebrane zostały w tabeli nr 1.
Tab. 1. Możliwe odczyny wodnych roztworów soli obojętnych.
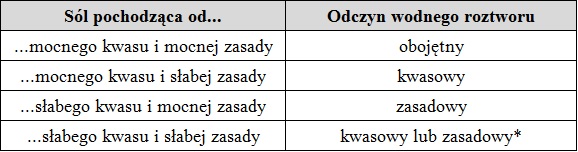
* Odczyn wodnego roztworu ściśle zależy od wartości stałych równowag reakcji dysocjacji powstałego kwasu i zasady. W praktyce odczyn takiego roztworu przyjmuje się jako bliski obojętnemu.
Jeśli sól obojętna pochodzi od: mocnego kwasu i słabej zasady, słabego kwasu i mocnej zasady, albo słabego kwasu i słabej zasady, należy rozważyć przebiegający w jej wodnym roztworze proces hydrolizy. Pod pojęciem mocnego kwasu można rozumieć związek chemiczny, którego stała równowagi reakcji dysocjacji kwasowej (Ka) ma wartość większą niż 10. Z kolei do mocnych zasad zaliczamy wodorotlenki metali grup 1 i 2 układu okresowego pierwiastków chemicznych, z wyłączeniem wodorotlenku berylu. Wartość pH uzyskanego roztworu wymienionych trzech rodzajów soli zwykle zależy od stężenia oraz mocy hydrolizującego kwasu (bądź zasady) Brønsteda, jakie powstają w wyniku dysocjacji elektrolitycznej soli. Ponadto trzeba mieć świadomość, że stosunkowo niewielki odsetek jonów ulega hydrolizie, w konsekwencji proces ten nie zawsze spowoduje znaczącą zmianę wartości pH roztworu względem wartości pH wody destylowanej.
Odczyn wodnego roztworu soli sprawdzamy za pomocą odpowiednich wskaźników kwasowo-zasadowych, które w kontakcie z nim, w sposób zauważalny zmieniają swą barwę.
Sole obojętne słabych kwasów oraz mocnych zasad.
W wodnych roztworach tego rodzaju soli przebiega proces hydrolizy anionowej. Na przykład w roztworze fluorku potasu ustala się równowaga:
F– + H2O ⇄ HF + OH–
Z powyższego równania reakcji hydrolizy wynika, że w wyniku jej przebiegu, w układzie zwiększa się liczba jonów wodorotlenkowych (OH–), odpowiedzialnych za zasadowy odczyn roztworu.
Liczba etapów procesu hydrolizy anionowej zależy od bezwzględnej wartości ładunku anionu, przy czym każdy kolejny etap tego procesu przebiega w dużo mniejszym stopniu, niż poprzedni. Dlatego też w praktyce następne etapy hydrolizy zwykle są pomijane. Przykładowo w roztworze węglanu potasu, w pierwszym etapie hydrolizuje jon węglanowy i ustala się równowaga:
CO32- + H2O ⇄ HCO3– + OH–
Można zapisać również równanie kolejnego etapu hydrolizy:
HCO3– + H2O ⇄ H2CO3 + OH–
Należy jednak pamiętać, że w etapie tym przebiegająca reakcja praktycznie nie ma wpływu na wartość pH roztworu.
Sole obojętne mocnych kwasów oraz słabych zasad.
W wodnych roztworach tego typu związków chemicznych przebiega proces hydrolizy kationowej. Na przykład w przypadku chlorku amonu (NH4Cl), od słabej zasady pochodzi kation amonu, który ulega hydrolizie zgodnie z równaniem:
NH4+ + H2O ⇄ NH3 + H3O+
Pojawienie się jonów H3O+ świadczy o kwasowym odczynie uzyskanego roztworu. Z kolei przyczyną kwasowego odczynu wodnych roztworów siarczanu(VI) cynku – soli pochodzącej od mocnego kwasu oraz słabej zasady – są równowagi opisane równaniami:
Zn2+ + H2O ⇄ ZnOH+ + H+
ZnOH+ + H2O ⇄ Zn(OH)2 + H+
Sole obojętne słabych kwasów oraz słabych zasad.
W wodnych roztworach tego rodzaju związków chemicznych przebiega proces hydrolizy kationowo-anionowej, przy czym reakcji tej ulegają oba jony budujące sól. Odczyn wodnego roztworu jest wówczas słabo kwasowy lub słabo zasadowy, co zależy od tego, który z powstałych w wyniku hydrolizy elektrolitów – kwas, czy zasada jest mocniejszy (ma większą wartość stałej równowagi reakcji dysocjacji). Na przykład, w wodnym roztworze propanianu amonu o wzorze C2H5COONH4 hydrolizie ulega jon NH4+ oraz C2H5COO–:
NH4+ + H2O ⇄ NH3 + H3O+
C2H5COO– + H2O ⇄ C2H5COOH + OH–
Jednocześnie, w układzie tym przebiega również reakcja opisana równaniem:
H3O+ + OH– ⟶ 2 H2O
Wartość stałej równowagi reakcji dysocjacji amoniaku (1,8∙10-5) jest większa od wartości stałej równowagi reakcji dysocjacji kwasu propanowego (1,4∙10-5) , zatem odczyn wodnego roztworu propanianu amonu jest słabo zasadowy. Z uwagi na stosunkowo niewielkie różnice w wartościach wymienionych stałych równowag można przyjąć, że odczyn tego roztworu jest praktycznie obojętny.
Odmiennie sytuacja przedstawia się w przypadku wodorosoli. Ten rodzaj związków chemicznych można przedstawić wzorem ogólnym w postaci:
Ma(HnR)b
We wzorze tym: M – to kation metalu (lub jon amonowy) o wartości bezwzględnej ładunku b, natomiast R – anion reszty kwasowej (o wartości bezwzględnej ładunku a), która zawiera n atomów wodoru (H), jakie mogłyby zostać oddysocjowane za pośrednictwem wody.
W wodnych roztworach niektórych rodzajów wodorosoli przebiegają konkurujące ze sobą: reakcja dysocjacji (odszczepienie jonu H+) oraz hydrolizy (przyłączanie jonu H+). Odczyn takiego roztworu będzie ściśle zależał od rodzaju kwasu oraz zasady, których pochodną jest rozpatrywana sól. Dane na temat możliwych odczynów wodnych roztworów wodorosoli zebrano w tabeli nr 2.
Tab. 2. Możliwe odczyny wodnych roztworów wodorosoli.
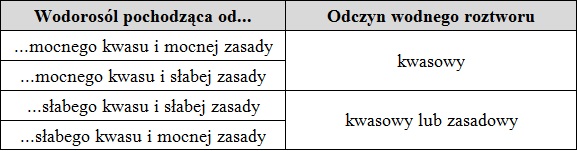
Wodorosole mocnych kwasów oraz mocnych/słabych zasad.
Jeśli wodorosól pochodzi od mocnej zasady, to wówczas taki związek chemiczny zbudowany jest z kationu metalu pierwszej lub drugiej grupy układu okresowego pierwiastków chemicznych (z wyłączeniem berylu) oraz anionu pochodzącego od mocnego wieloprotonowego kwasu. Przykładem jest wodorosiarczan(VI) sodu, który w wodnych roztworach dysocjuje zgodnie z równaniem:
NaHSO4 ⟶ Na+ + HSO4–
Wodorosiarczan(VI) sodu jest pochodną kwasu siarkowego(VI) – mocnego kwasu, który ulega dwuetapowej reakcji dysocjacji elektrolitycznej, przy czym pierwszy jej etap przebiega praktycznie całkowicie:
Etap 1: H2SO4 + H2O ⟶ HSO4– + H3O+ Ka1 = 103
Etap 2: HSO4– + H2O ⇄ SO42- + H3O+ Ka2 = 1,02∙10-2
Zauważ, że anion HSO4– może odszczepić proton, jak również może go przyjąć, zatem może być kwasem, albo zasadą Brønsteda. Możemy przewidzieć, który z procesów będzie dominował w wodnym roztworze wodorosoli – dysocjacja, czy hydroliza. W tym celu należy określić, która ze stałych równowag ma większą wartość – stała równowagi reakcji dysocjacji kwasowej, czy też stała równowagi reakcji hydrolizy anionowej. Aby łatwiejsze stało się zrozumienie tego zagadnienia, najpierw pokrótce przypomnimy sobie czym jest iloczyn jonowy wody.
W chemicznie czystej (wolnej od innych substancji) wodzie oraz jej roztworach, na skutek autodysocjacji cząsteczek wody ustala się równowaga dynamiczna opisana równaniem:
H2O + H2O ⇄ H3O+ + OH–
Z powyższego równania reakcji wynika, że w roztworach o odczynie obojętnym stężenie molowe jonów oksoniowych (H3O+) i wodorotlenkowych są identyczne, a wielkością opisującą tę równowagę jest stała równowagi (Kw), zwana iloczynem jonowym wody:
Kw = [H3O+][ OH–]
W temperaturze 22 oC iloczyn ten ma wartość 10-14 i rośnie wraz ze wzrostem temperatury. W przedstawionym równaniu, wyrażenia [H3O+] oraz [OH–] są stężeniami molowymi jonów, odpowiednio – oksoniowych oraz wodorotlenkowych.
Rozważając wodne roztwory soli pochodzących od słabego kwasu i mocnej zasady oraz mocnego kwasu i słabej zasady, istnieje relacja:
Ka∙Kb = Kw
Ka jest wartością stałej równowagi reakcji dysocjacji kwasu, natomiast Kb to wartość stałej równowagi reakcji hydrolizy sprzężonej z nim zasady Brønsteda.
Obliczmy teraz wartość stałej równowagi reakcji hydrolizy (Kb) anionu wodorosiarczanowego(VI). W tym celu do powyższego równania za Ka podstawiamy wartość stałej dysocjacji kwasu H2SO4 i uzyskujemy zależność:
103∙Kb=10-14
Stąd wartość stałej hydrolizy (Kb) anionu wodorosiarczanowego(VI) (czyli HSO4–) równa jest 10-17. Porównajmy tę wartość z wartością stałej dysocjacji Ka tego anionu, która wynosi 1,02∙10-2. Ponieważ stała równowagi reakcji dysocjacji kwasowej (1,02∙10-2) ma wartość większą od wartości stałej hydrolizy (10-17), w konsekwencji wodne roztwory wodorosiarczanów(VI) mają odczyn kwasowy. Oznacza to, że hydroliza anionowa praktycznie w nich nie przebiega.
Przykładem wodorosoli pochodzącej od mocnego, wieloprotonowego kwasu i słabej zasady jest wodorosiarczan(VI) amonu. W przypadku tego rodzaju związków chemicznych, odczyn ich wodnych roztworów również będzie kwasowy, co rozpatrujemy analogicznie jak wyżej – porównując wartości stałych równowagi reakcji hydrolizy oraz dysocjacji wodoroanionu.
Wodorosole słabych kwasów oraz słabych zasad.
W przypadku tego rodzaju wodorosoli mamy do czynienia zarówno z procesem dysocjacji elektrolitycznej, jak i hydrolizy, ponieważ oba budujące sól jony pochodzą od słabych elektrolitów. Przykładem może być wodorowęglan amonu o wzorze NH4HCO3. Porównując wartości stałych równowag reakcji hydrolizy (2,24∙10-8) oraz dysocjacji kwasowej (4,69∙10-11) jonu wodorowęglanowego i hydrolizy jonu amonowego (5,55∙10-10) można zauważyć, że wśród opisanych procesów najłatwiej przebiega pierwszy wymieniony, stąd odczyn wodnego roztworu wodorowęglanu amonu jest zasadowy.
Innym przykładem wodorosoli pochodzącej od słabego kwasu oraz słabej zasady jest wodorosiarczan(IV) amonu. Porównując wartości stałych równowag reakcji hydrolizy (8,13∙10-13) oraz dysocjacji kwasowej (6,61∙10-8) jonu wodorosiarczanowego(IV) i hydrolizy jonu amonowego (5,55∙10-10) można zauważyć, że wśród opisanych procesów najłatwiej przebiega drugi wymieniony, stąd odczyn wodnego roztworu wodorosiarczanu(IV) amonu jest kwasowy.
Wodorosole słabych kwasów oraz mocnych zasad.
W wodnych roztworach tego rodzaju wodorosoli rozpatrujemy jedynie możliwość przebiegu reakcji dysocjacji lub hydrolizy wodoroanionu. Dominująca jest ta reakcja, której stała równowagi ma większą wartość. Na przykład wodny roztwór wodorowęglanu potasu ma odczyn zasadowy (anion HCO3– łatwiej ulega hydrolizie anionowej, niż dysocjacji kwasowej), z kolei roztwór wodorosiarczanu(IV) sodu ma odczyn kwasowy, ponieważ anion HSO3– łatwiej ulega reakcji dysocjacji kwasowej, niż hydrolizy.
Interesująco przedstawia się analiza odczynów wodnych roztworów wodorosoli pochodzących od kwasu ortofosforowego(V) i mocnej zasady (na przykład wodorotlenku sodu). Kwas ortofosforowy(V) jest kwasem klasyfikowanym jako średnio mocny, a w jego wodnych roztworach ustala się równowaga opisana kolejnymi równaniami:
Etap 1: H3PO4 + H2O ⇄ H2PO4– + H3O+ Ka1 = 7,11∙10-3
Etap 2: H2PO4– + H2O ⇄ HPO42- + H3O+ Ka2 = 6,34∙10-8
Etap 3: HPO42- + H2O ⇄ PO43- + H3O+ Ka3 = 4,36∙10-13
Kwas ten tworzy dwa rodzaje wodorosoli pochodzących od mocnej zasady. Jako przykłady mogą posłużyć wodoroortofosforan(V) potasu (K2HPO4) oraz diwodoroortofosforan(V) potasu (KH2PO4).
Teraz spróbuj określić odczyny ich wodnych roztworów, uzasadniając swoją odpowiedź odpowiednimi obliczeniami, a następnie równaniami reakcji chemicznych zapisanymi w formie jonowej skróconej…
Dane na temat wartości stałych równowag oraz iloczynu jonowego wody pochodzą z następujących źródeł literaturowych:
1. L. Jones, P. W. Atkins, Chemia ogólna. Cząsteczki, materia, reakcje, Wydawnictwo Naukowe PWN, Warszawa 2018.
2. K.-H. Lautenschläger, W. Schröter, A. Wanninger, Nowoczesne kompendium chemii, Wydawnictwo Naukowe PWN, Warszawa 2018.
3. W. Mizerski, Tablice chemiczne, Wydawnictwo Adamantan, Warszawa 2013.
Spodobał Ci się ten artykuł? Polub mój fanpage na Facebooku oraz na Instagramie, aby nie ominęły Cię żadne nowości.
Więcej informacji na temat równowag w roztworach wodnych znajdziesz w podręczniku „Projektowanie doświadczeń chemicznych. Dla maturzystów i nie tylko”; szczegółowe informacje o tej publikacji znajdziesz tutaj.
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Czy można w reakcji hydrolizy zapisywać H2CO3?
Spotkałem się z zapisem H2O•CO2
Możemy. Wówczas równanie procesu będzie następujące: HCO3(–) + H2O ⇄ H2CO3 + OH–