15.10.2023 | 0 komentarze
Pierwsza energia jonizacji jest najmniejszą energią jaką należy dostarczyć, aby od atomu oderwać jeden elektron. W przypadku atomów wieloelektronowych istnieje możliwość odrywania kolejnych elektronów – mówimy wtedy o drugiej, trzeciej i kolejnych energiach jonizacji. W otaczającej nas przyrodzie obserwujemy wiele różnych prawidłowości. Nie inaczej jest również w chemii. Dziś przeanalizujemy jak zmienia się energia jonizacji, w zależności od położenia pierwiastka grupy głównej w układzie okresowym. Dlaczego zajmiemy się grupami głównymi? Ponieważ trendy wśród leżących w nich pierwiastków chemicznych są najlepiej zauważalne, a ich znajomość obowiązywać Cię będzie na maturze z chemii…
Jako pierwszą rozważymy prawidłowość dotyczącą zmian energii jonizacji wśród pierwiastków leżących w tej samej grupie głównej układu okresowego. Energia ta zależy od długości promienia atomowego. Gdy w danej grupie poruszamy się podążając od pierwiastka o najmniejszej liczbie atomowej do pierwiastka o największej liczbie atomowej, obserwujemy wtedy, że każdy kolejny element ma o jedną powłokę elektronową więcej od swojego poprzednika. Znajduje to swoje odbicie w długości promienia atomowego, która wzrasta w opisanym kierunku, co schematycznie ilustruje poniższy rysunek:

Jaki ma to związek z energią jonizacji? Najłatwiej oderwać jest ten elektron, który najsłabiej oddziałuje z protonami jądra atomowego, mówiąc prościej – jest słabiej przez nie przyciągany. Jest to spowodowane wzrostem odległości elektronu walencyjnego od jądra atomowego. Aby oderwać elektron znajdujący się bliżej jądra atomowego należy dostarczyć więcej energii, ponieważ elektron taki jest silniej przyciągany przez jądro atomowe, dlatego na przykład pierwsza energia jonizacji litu (2 powłoki elektronowe) jest mniejsza niż pierwsza energia jonizacji potasu (4 powłoki elektronowe). Trend taki zachowany jest w każdej grupie głównej układu okresowego, co schematycznie ilustruje rysunek:

Na niżej zamieszczonym wykresie obrazującym zmiany pierwszej energii jonizacji pierwiastków grup głównych (z wyłączeniem helowców), linie łączące punkty (odpowiadające pierwszej energii jonizacji danego pierwiastka) mają jedynie na celu poprawienie czytelności rysunku:
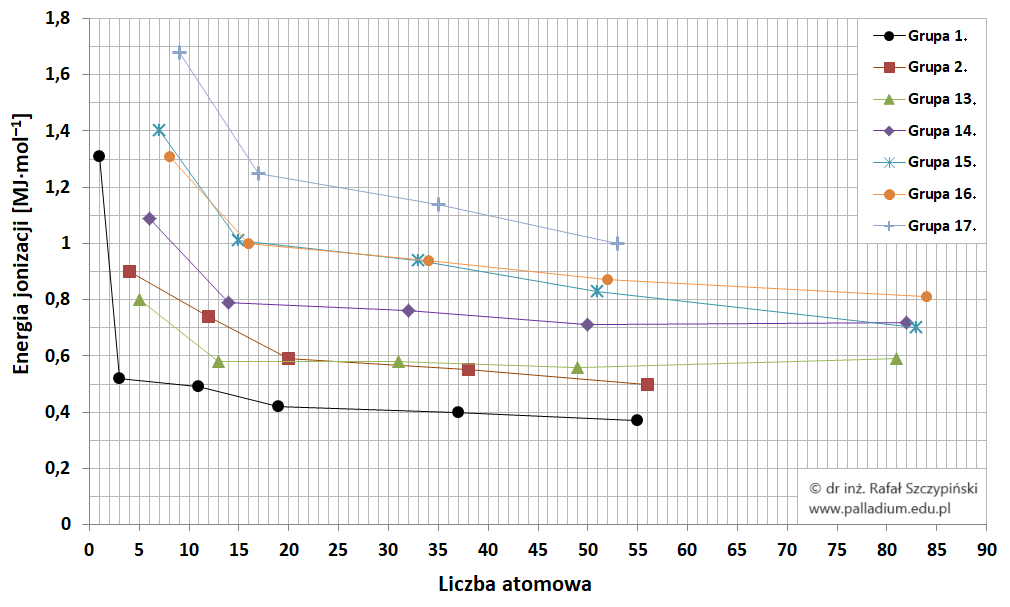
Z danych tych wynika, że wraz ze wzrostem promienia atomowego praktycznie każdorazowo obserwujemy spadek wartości pierwszej energii jonizacji, co jest swego rodzaju potwierdzeniem opisanego wcześniej trendu.
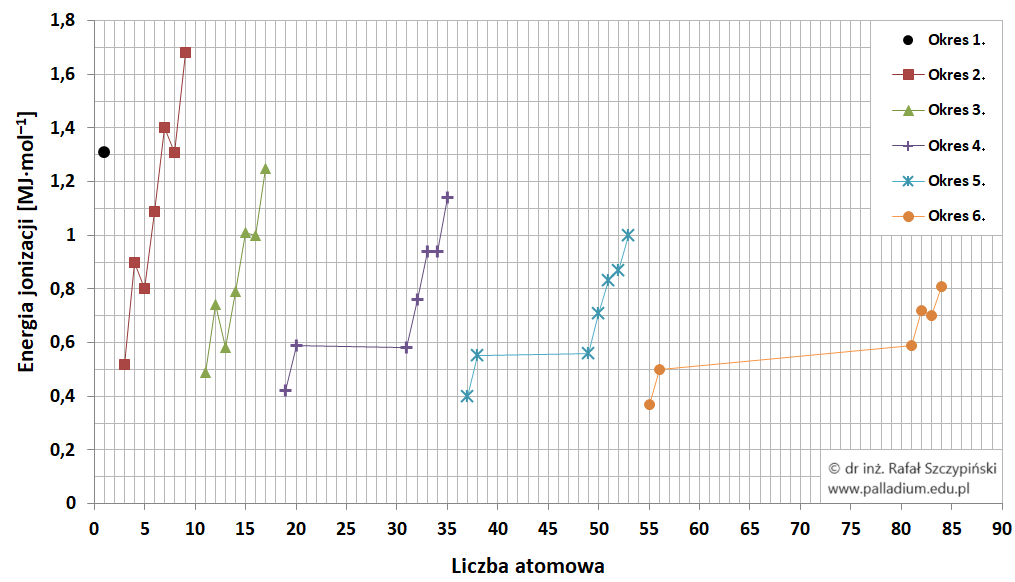
W przypadku pierwiastków grup głównych leżących w tym samym okresie, wartość pierwszej energii jonizacji również zależy od długości promienia atomowego, którego długość maleje wraz ze wzrostem liczby atomowej pierwiastka, lub mówiąc inaczej – promień atomowy wrasta ze spadkiem liczby atomowej:

Im większy jest dodatni ładunek jądra atomowego, tym elektrony walencyjne są wtedy silniej przyciągane przez protony. W efekcie możemy wyobrazić sobie, że atom silniej „kurczy się”, co oznacza, że elektrony walencyjne znajdują się coraz bliżej jądra atomowego. Wnioskujemy, że w konsekwencji takiego zjawiska pierwsza energia jonizacji powinna wzrastać w okresie wraz ze wzrostem liczby atomowej pierwiastka chemicznego. Każdy okres otwiera zatem litowiec o najniższej w danym okresie wartości pierwszej energii jonizacji, a zamyka helowiec o najwyższej wśród pierwiastków danego okresu energii jonizacji. Opisany trend schematycznie ilustruje rysunek:

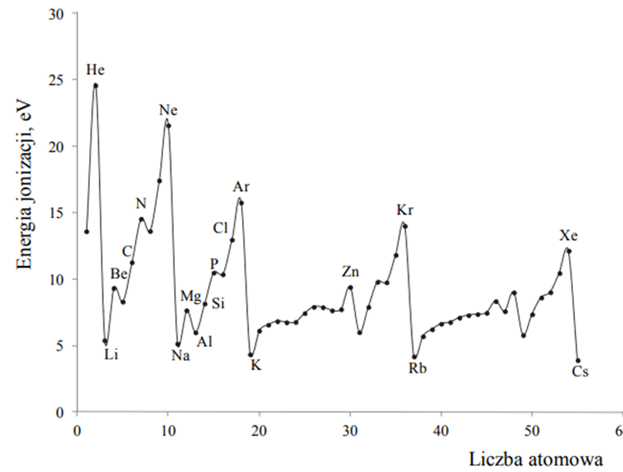
Czy jednak opisany wniosek jest właściwy? Czy faktycznie wartość energii jonizacji będzie w sposób ciągły rosnąć w okresie w miarę pojawiania się kolejnych pierwiastków, ułożonych według wzrastającej liczby atomowej? Wymieniony trend rzeczywiście istnieje, jednak pojawiają się w nim pewne odstępstwa… Przeanalizujmy zatem dane literaturowe, w których dla uproszczenia pominięto helowce:
Analizując przebieg wykresu obserwujemy niewielkie obniżenie wartości pierwszej energii jonizacji w okresie drugim oraz trzecim. Sytuacja taka ma miejsce po całkowitym zapełnieniu elektronami podpowłok – 2s (atom berylu) oraz 3s (atom magnezu) i połowicznym zapełnieniu podpowłok – 2p (atom azotu) oraz 3p (atom fosforu). Dlaczego tak się dzieje? Ponieważ obserwuje się większą trwałość układów, w których podpowłoki zapełnione są elektronami całkowicie lub połowicznie. Oznacza to, że łatwiej oderwać jest na przykład pojedynczy elektron z niecałkowicie zapełnionej podpowłoki 3p atomu glinu, niż z całkowicie zapełnionej podpowłoki 3s atomu magnezu. Podobnie łatwiej jest oderwać jeden elektron z częściowo zapełnionej podpowłoki 2p atomu tlenu, niż z połowicznie zapełnionej podpowłoki 2p atomu azotu.
Teraz już wiesz, że prawo okresowości nie jest czymś zerojedynkowym, dlatego również i tutaj obserwuje się pewne odstępstwa od istniejących trendów… Nie martw się jednak na zapas, ponieważ w zadaniach maturalnych wszelkie odstępstwa od znanych Ci reguł zostaną odpowiednio opisane.
Dane empiryczne na podstawie których opracowano wykresy przedstawiające zależność energii jonizacji od liczby atomowej pochodzą z podręcznika A. Bielańskiego, Podstawy chemii nieorganicznej, Warszawa 2010.
Spodobał Ci się ten artykuł? Polub mój fanpage na Facebooku oraz na Instagramie, aby nie ominęły Cię żadne nowości.
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone