28.05.2023 | 0 komentarze

Stechiometria mieszanin jest jednym z tych tematów, które sprawiają uczniom niemal zawsze najwięcej problemów. Dziś przybliżę sposób przeliczania stosunku masowego na molowy oraz molowego na masowy składników mieszaniny złożonej z dwóch substancji chemicznych. Aby łatwiej było zrozumieć przeliczanie stosunku masowego na molowy posłużymy się poniższym zadaniem.
Stosunek masowy CH2Cl2 do CCl4 wynosi 6,8 : 9,24 i jest to po prostu stosunek wartości liczbowych mas tych związków chemicznych.
Co istotne – nie musisz wyrażać tego stosunku za pomocą najmniejszych liczb naturalnych, choć zdecydowanie lepiej wygląda wynik zapisany w postaci 170:231, którą uzyskujemy w wyniku kolejnych działań opisanych w dalszej części artykułu. Mnożymy wartość licznika oraz mianownika przez 100, aby uzyskać stosunek wartości liczb naturalnych:
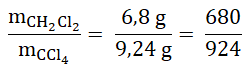
W celu uproszczenia uzyskanego stosunku wartości liczbowych, wartość licznika oraz mianownika dzielimy przez 4, co ostatecznie prowadzi do wyniku:
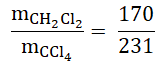
Wróćmy jednak do przeliczenia stosunku masowego na molowy. Będziemy potrzebować wartości mas molowych składników CH2Cl2 (85 g∙mol–1) oraz CCl4 (154 g∙mol–1). Następnie obliczamy:
ilu molom CH2Cl2 odpowiada jego ilość o podanej masie 6,8 g. Zatem n = 6,8 g : 85 g∙mol–1 = 0,08 mola
ilu molom CCl4 odpowiada jego ilość o podanej masie 9,24 g. Zatem n = 9,24 g : 154 g∙mol–1 = 0,06 mola
Z powyższych obliczeń wynika, że w naszej mieszaninie znajduje się 0,08 mola CH2Cl2 oraz 0,06 mola CCl4. Zapisujemy zatem stosunek wartości liczb moli:
![]()
Jest to jedna z możliwych odpowiedzi do zadania, choć zdecydowanie lepiej wynik wyglądałby jako stosunek wyrażony wartościami możliwie najmniejszych liczb naturalnych. Jak można uzyskać taką postać? Wystarczy wartość licznika i mianownika doprowadzić najpierw do stosunku wartości liczb naturalnych – mnożąc każdą z nich przez 100. W efekcie prowadzi to do wyrażenia w postaci: CH2Cl2 : CCl4 = 8 : 6, a po jego uproszczeniu (dzielenie przez 2) uzyskujemy ostatecznie: CH2Cl2 : CCl4 = 4 : 3.
Odpowiedź: stosunek molowy CH2Cl2 do CCl4 wynosi 4 : 3.
Zapamiętaj, że nie ma odgórnego nakazu podawania stosunku molowego w formie stosunku wartości liczbowych wyrażonego możliwie najmniejszymi liczbami naturalnymi.
Wiesz już w jaki sposób przeliczać stosunek masowy na molowy składników mieszaniny. W dalszej części artykułu pokażę Ci w jaki sposób można przeliczyć stosunek molowy składników mieszaniny na stosunek masowy. W tym celu rozwiążemy poniższe zadanie.
Stosunek molowy Fe do S wynosi 4 : 7, co oznacza, że na każde 4 mole żelaza w tej mieszaninie przypada 7 moli siarki. Przeliczamy zatem podane liczby moli na masy. W tym celu będziemy potrzebować wartości mas molowych składników Fe (56 g∙mol–1) oraz S (32 g∙mol–1). Następnie obliczamy:
jakiej masie Fe odpowiada podana liczba moli równa 4. Zatem m = 4 mole ∙ 56 g∙mol–1 = 224 g
jakiej masie S odpowiada podana liczba moli równa 7. Zatem m = 7 moli ∙ 32 g∙mol–1 = 224 g
Z powyższych obliczeń wynika, że w naszej mieszaninie znajduje się 224 g Fe oraz 224 g S. Zapisujemy zatem stosunek wartości mas tych substancji:
mFe : mS = 224 : 224, a po uproszczeniu (dzielenie przez 224 obu wartości liczbowych) uzyskujemy: mFe : mS = 1 : 1, co jest odpowiedzią do zadania.
Spodobał Ci się ten artykuł? Polub mój fanpage na Facebooku oraz na Instagramie, aby nie ominęły Cię żadne nowości.
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone