Poli(tlenek etylenu) jest polimerem o następującej strukturze:
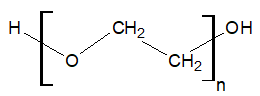
Związek ten jest przedstawicielem polieterów – związków chemicznych, w cząsteczkach których jednostki powtarzalne stanowią na przemian ułożone atomy tlenu oraz ugrupowania węglowodorowe.
Powstałe w wyniku polimeryzacji łańcuchy poli(tlenku etylenu) różnią się masą molową, ponieważ ich długość nie jest jednakowa. Możliwe jest jednak określenie średniej masy molowej takiego polimeru wykorzystując zjawisko osmozy. W tym celu, w temperaturze T (Kelwiny) wyznacza się wyrażone w kPa ciśnienie osmotyczne (Π) próbki roztworu badanej substancji, a następnie oblicza jej stężenie molowe (Cm) z równania van’t Hoffa:
Π = i∙R∙T∙Cm
W równaniu tym R jest stałą gazową o wartości 8,31 Pa∙m3∙mol–1∙K–1, natomiast wielkość i to współczynnik van’t Hoffa, który w przypadku rozcieńczonych roztworów nieelektrolitów zwykle przyjmuje wartość 1. Znając masę próbki badanej substancji oraz jej liczbę moli można obliczyć średnią masę molową.
Na podstawie: P. W. Atkins, L. Jones, Chemia ogólna. Cząsteczki, materia, reakcje, Warszawa 2018.
W temperaturze 25 oC przygotowano 200 cm3 wodnego roztworu poli(tlenku etylenu), zwierającego 1,5 g próbki tego polimeru. Uzyskana w opisanych warunkach mieszanina ma ciśnienie osmotyczne 4,2 kPa.
Ustal średnią liczbę merów w łańcuchach polimerowych znajdujących się w opisanej próbce poli(tlenku etylenu). Wynik podaj z dokładnością do najbliższej liczby naturalnej.
Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem:
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone