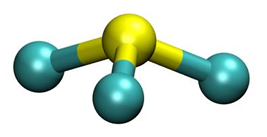
Określanie symboli pierwiastków chemicznych, ich elektronów walencyjnych oraz bloku energetycznego. Zadanie 1.1. Arkusz CKE chemia maj 2025 rozszerzony (2 punkty)
O dwóch pierwiastkach umownie oznaczonych literami E i X wiadomo, że:
• elektrony atomu E w stanie podstawowym zajmują osiem orbitali, przy czym sześć z nich jest całkowicie zapełnionych
• konfigurację elektronową atomu X w jednym ze stanów wzbudzonych przedstawia poniższy zapis.
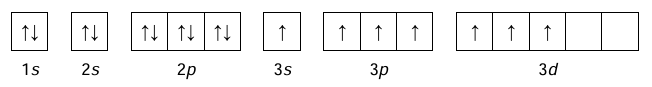
Uzupełnij tabelę. Napisz symbole pierwiastków E i X, symbol bloku konfiguracyjnego, do którego należy każdy z pierwiastków, oraz podaj sumaryczną liczbę elektronów w podpowłokach walencyjnych.
Przypisywanie wartości liczb kwantowych. Zadanie 1.2. Arkusz CKE chemia maj 2025 rozszerzony (1 punkt)
O dwóch pierwiastkach umownie oznaczonych literami E i X wiadomo, że:
• elektrony atomu E w stanie podstawowym zajmują osiem orbitali, przy czym sześć z nich jest całkowicie zapełnionych
• konfigurację elektronową atomu X w jednym ze stanów wzbudzonych przedstawia poniższy zapis.

Uzupełnij tabelę. Napisz wartości dwóch liczb kwantowych: głównej i pobocznej, które opisują stan kwantowy jednego z niesparowanych elektronów atomu E w stanie podstawowym.
Zapis pełnej konfiguracji podpowłokowej anionu. Zadanie 1.3. Arkusz CKE chemia maj 2025 rozszerzony (1 punkt)
O dwóch pierwiastkach umownie oznaczonych literami E i X wiadomo, że:
• elektrony atomu E w stanie podstawowym zajmują osiem orbitali, przy czym sześć z nich jest całkowicie zapełnionych
• konfigurację elektronową atomu X w jednym ze stanów wzbudzonych przedstawia poniższy zapis.

Przedstaw pełną konfigurację elektronową jonu X– w stanie podstawowym. Zastosuj zapis konfiguracji elektronowej z uwzględnieniem podpowłok.
Uzupełnienie schematu reakcji rozszczepienia atomu uranu. Zadanie 2.1. Arkusz CKE chemia maj 2025 rozszerzony (1 punkt)
Niektóre ciężkie jądra ulegają reakcjom rozszczepienia. Takie jądra bombardowane neutronami ulegają podziałowi na dwa lżejsze fragmenty. Tej przemianie towarzyszy emisja dwóch lub trzech neutronów.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2018.
W jednej z reakcji rozszczepienia jąder 235U powstają 92Kr oraz 141Ba.
Uzupełnij schemat tak, aby otrzymać równanie opisanej przemiany, która prowadzi do powstania jąder kryptonu i baru.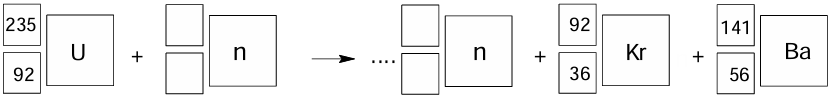
Wybór właściwych wyrażeń w nawiasach. Zadanie 2.2. Arkusz CKE chemia maj 2025 rozszerzony (1 punkt)
Niektóre ciężkie jądra ulegają reakcjom rozszczepienia. Takie jądra bombardowane neutronami ulegają podziałowi na dwa lżejsze fragmenty. Tej przemianie towarzyszy emisja dwóch lub trzech neutronów.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2018.
W jednej z reakcji rozszczepienia jąder 235U powstają 92Kr oraz 141Ba.
Uzupełnij zdania. Zaznacz jedną odpowiedź spośród podanych w każdym nawiasie. Jeżeli po pochłonięciu jednego neutronu przez jądro 235U następuje jego rozszczepienie, w wyniku którego powstaje jądro 93Sr i są emitowane 3 neutrony, to równocześnie tworzy się jądro ( 139I / 140Xe / 140Ba ). Wśród jąder biorących udział w tej przemianie większy stosunek liczby neutronów do liczby protonów ma jądro ( 235U / 93Sr ).
Zapis równania reakcji tlenku jodu(V) z wodą. Zadanie 3.1. Arkusz CKE chemia maj 2025 rozszerzony (1 punkt)
Jod tworzy wiele połączeń z tlenem np. tlenek jodu(V), który jest białym ciałem stałym. W reakcji tego związku z wodą powstaje jednoprotonowy kwas. Opisany tlenek jest stosowany do wykrywania i oznaczania zawartości tlenku węgla(II) w powietrzu.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2018.
Napisz w formie cząsteczkowej równanie opisanej reakcji tlenku jodu(V) z wodą.
Zapis równania reakcji tlenku jodu(V) z tlenkiem węgla(II). Zadanie 3.2. Arkusz CKE chemia maj 2025 rozszerzony (1 punkt)
Jod tworzy wiele połączeń z tlenem np. tlenek jodu(V), który jest białym ciałem stałym. W reakcji tego związku z wodą powstaje jednoprotonowy kwas. Opisany tlenek jest stosowany do wykrywania i oznaczania zawartości tlenku węgla(II) w powietrzu.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2018.
Przeprowadzono doświadczenie. W kolbie ustawionej pod wyciągiem umieszczono tlenek jodu(V), a następnie wprowadzono do niej tlenek węgla(II) i szczelnie ją zamknięto. Wygląd zawartości kolby, w której zachodzi reakcja utleniania-redukcji, przedstawiono na zdjęciu.

Napisz w formie cząsteczkowej równanie reakcji tlenku jodu(V) z tlenkiem węgla(II).
Ustalanie wzoru empirycznego oraz rzeczywistego tlenku jodu. Zadanie 4. Arkusz CKE chemia maj 2025 rozszerzony (2 punkty)
W jednym z tlenków jodu masa tlenu stanowi 20,14 % masy tego tlenku. W jego wzorze rzeczywistym liczba atomów jodu jest dwa razy większa niż we wzorze empirycznym.
Na podstawie obliczeń ustal i napisz wzór empiryczny oraz wzór rzeczywisty opisanego tlenku. Wzór empiryczny: Wzór rzeczywisty:
Zapis równania reakcji redukcji oraz uzupełnienie schematu reakcji. Zadanie 5.1. Arkusz CKE chemia maj 2025 rozszerzony (2 punkty)
W odpowiednich warunkach fluorowce mogą ze sobą reagować i tworzyć tzw. związki międzyhalogenowe o wzorze ogólnym AX𝑦, w którym 𝑦 przyjmuje wartość 1, 3, 5 lub 7. W tym wzorze A oznacza pierwiastek o mniejszej elektroujemności, a X – pierwiastek o większej elektroujemności. Przykładem związku międzyhalogenowego jest trichlorek jodu o wzorze ICl3.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2018.
Trichlorek jodu został po raz pierwszy otrzymany w reakcji, której schemat przedstawiono poniżej.
![]()
Napisz w formie jonowej, z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy), równanie reakcji redukcji zachodzącej podczas tej przemiany. Uwzględnij środowisko reakcji. Uzupełnij współczynniki stechiometryczne w poniższym schemacie. Równanie reakcji redukcji:
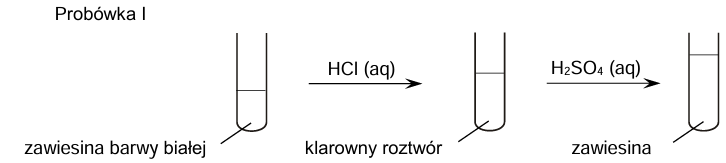
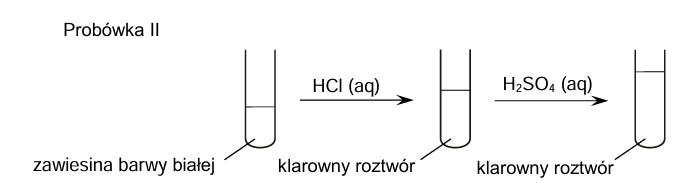
Rozstrzygnięcie z uzasadnieniem, w której probówce uzyskano osad wyłącznie tlenku metalu. Zadanie 6. Arkusz CKE chemia maj 2025 rozszerzony (1 punkt)
Uczniowie wykonali dwuetapowe doświadczenie, którego celem było otrzymanie czystego tlenku miedzi(II). W pierwszym etapie strącili wodorotlenek miedzi(II), a w drugim etapie przeprowadzili jego rozkład termiczny w łaźni wodnej. Następnie uzyskaną mieszaninę przesączyli, żeby wyodrębnić stały produkt.
Na poniższym schemacie przedstawiono pierwszy etap doświadczenia.
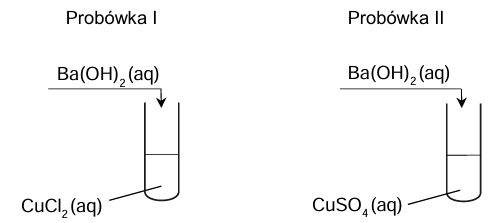
Rozstrzygnij, w której probówce (I czy II) otrzymano osad tylko tlenku metalu. Odpowiedź uzasadnij. Rozstrzygnięcie: Uzasadnienie:
Zapis wzorów sumarycznych odpowiednich wodorotlenków. Zadanie 7.1. Arkusz CKE chemia maj 2025 rozszerzony (1 punkt)
W probówkach oznaczonych numerami I–IV umieszczono oddzielnie, w przypadkowej kolejności, wodne roztwory soli różnych metali. Do probówek wprowadzono roztwór wodorotlenku sodu, w wyniku czego w każdej z nich pojawiła się zawiesina innego wodorotlenku:
Cr(OH)3 Ca(OH)2 Cu(OH)2 Al(OH)3
Zawiesiny otrzymane w probówkach I i II posłużyły do przeprowadzenia doświadczenia zgodnie ze schematem.
Uzupełnij tabelę. Spośród wodorotlenków wymienionych w informacji wstępnej wybierz te, których zawiesiny znajdowały się na początku doświadczenia w probówkach I i II. Napisz wzory tych związków.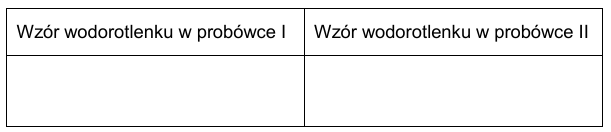
Zapis równań reakcji chemicznych. Zadanie 7.2. Arkusz CKE chemia maj 2025 rozszerzony (2 punkty)
W probówkach oznaczonych numerami I–IV umieszczono oddzielnie, w przypadkowej kolejności, wodne roztwory soli różnych metali. Do probówek wprowadzono roztwór wodorotlenku sodu, w wyniku czego w każdej z nich pojawiła się zawiesina innego wodorotlenku:
Cr(OH)3 Ca(OH)2 Cu(OH)2 Al(OH)3
Probówkę III umieszczono na pewien czas w łaźni wodnej.
Wygląd zawartości tej probówki po ogrzaniu przedstawiono na
zdjęciu A.
Do zawiesiny wodorotlenku znajdującego się w probówce IV
dodano roztwór wodorotlenku sodu – wygląd zawartości tej
probówki przedstawiono na zdjęciu B.

Napisz równania reakcji: • w formie cząsteczkowej – termicznego rozkładu wodorotlenku znajdującego się w probówce III (reakcja 1.) Reakcja 1.: Reakcja 2.:
• w formie jonowej skróconej – roztwarzania wodorotlenku znajdującego się w probówce IV (reakcja 2.).
Obliczanie jaka część KBr uległa reakcji chemicznej. Zadanie 8. Arkusz CKE chemia maj 2025 rozszerzony (2 punkty)
W celu otrzymania kwasu bromowodorowego przeprowadzono doświadczenie z użyciem zestawu, który zilustrowano rysunkiem obok. Do kolby stożkowej zawierającej 9,5 g czystego stałego bromku potasu wprowadzono kroplami pewną ilość stężonego kwasu siarkowego(VI). Zaszła reakcja opisana poniższym równaniem.
KBr + H2SO4 → KHSO4 + HBr
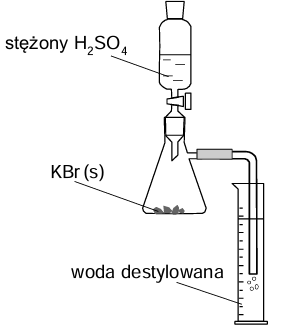
W wyniku całkowitego pochłonięcia wydzielonego bromowodoru otrzymano w cylindrze 80 cm3 kwasu bromowodorowego. Z tego roztworu pobrano próbkę 1,0 cm3, którą rozcieńczono wodą. Do jej zobojętnienia zużyto 6,9 cm3 roztworu wodorotlenku potasu o pH = 13.
Oblicz, jaka część użytego w doświadczeniu KBr uległa reakcji z H2SO4. Wynik podaj w procentach.
Zapis równań reakcji chemicznych w formie jonowej skróconej. Zadanie 9. Arkusz CKE chemia maj 2025 rozszerzony (2 punkty)
Pod wyciągiem przeprowadzono dwa doświadczenia, których celem było zbadanie przebiegu reakcji metali z kwasami. Użyto poniższych odczynników:
cynk srebro kwas solny kwas azotowy(V)
Każdy z reagentów został użyty tylko raz. Przebieg doświadczeń przedstawiono na poniższych zdjęciach.

Napisz w formie jonowej skróconej równania reakcji zachodzących podczas doświadczeń 1. i 2. Doświadczenie 1.: Doświadczenie 2.: