10.10.2019 | 8 komentarze

Z pewnością zdarzało Ci się zastanawiać, czy dana cząsteczka ma budowę polarną, czy też nie? W poniższym artykule nieco przybliżę to zagadnienie.
O tym, czy cząsteczka jest polarna, czy nie ma takiej budowy decyduje rozłożenie ładunku elektrycznego w jej obrębie. Miarą rozłożenia tego ładunku jest wielkość zwana momentem dipolowym (μ), a jego jednostką jest D (debaj). Im większą wartość ma moment dipolowy cząsteczki, tym jest ona bardziej polarna. Na przykład, cząsteczka HCl jest dipolem elektrycznym (μ = 1,08 D). Elektroujemność atomu chloru jest wartością większą od wartości elektroujemności atomu wodoru, dlatego chlor silniej przyciąga w swoim kierunku wiążącą (tworzącą wiązanie chemiczne) parę elektronową, a zatem gęstość ładunku ujemnego w obrębie tego atomu jest większa. Mówimy wówczas, że na atomie chloru zlokalizowany jest cząstkowy ładunek ujemny (δ-) , a zatem na atomie wodoru zlokalizowany jest wtedy cząstkowy ładunek dodatni (δ+). Wzór elektronowy kreskowy cząsteczki chlorowodoru z zaznaczonymi ładunkami cząstkowymi przedstawia rysunek:
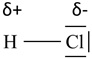
Cząsteczka tego związku chemicznego ma wiązanie kowalencyjnej spolaryzowane. Obecność takiego wiązania chemicznego nie zawsze jest gwarancją, że cząsteczka stanowić będzie dipol elektryczny. Bardzo dobrym tego przykładem jest tlenek węgla(IV), czyli CO2:
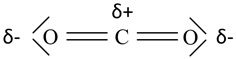
Cząsteczka CO2 ma budowę liniową, a oba wiązania węgiel-tlen mają taką samą długość oraz polaryzację w kierunku atomów tlenu. W konsekwencji momenty dipolowe wiązań chemicznych znoszą się wzajemnie, co skutkuje wartością jej momentu dipolowego równą zero (μ = 0).
Jaką w takim razie strukturę powinna mieć cząsteczka, aby nie była dipolem elektrycznym (nie była polarna)?
Niepolarne są cząsteczki homoatomowe (zbudowane z atomów tego samego pierwiastka chemicznego):
1. O budowie liniowej – typu A2 na przykład H2, Cl2.
2. O kształcie tetraedru – typu A4, na przykład P4.
3. W przypadku tzw. cząsteczek heteroatomowych (zbudowanych z atomów różnych pierwiastków chemicznych) opisane zagadnienie jest nieco bardziej skomplikowane. Modele budowy przestrzennej tego typu drobin przedstawiają rysunki poniżej, na których czarne oraz szare koła oznaczają:

Ponadto modele te uwzględniają jedynie typy hybrydyzacji orbitali walencyjnych atomu centralnego: sp, sp2 oraz sp3, co zaznaczone zostało w opisie każdego z nich.
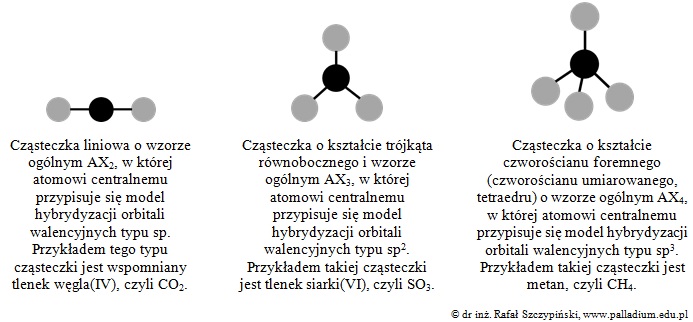
Gdyby w którymkolwiek z wyżej narysowanych modeli zamienić jeden (lub kilka) z ligandów na inny (albo na wolną parę elektronową), wówczas cząsteczka taka będzie mieć budowę polarną.
W przypadku bardziej złożonych cząsteczek, takich jak izomery geometryczne cis-trans, czy też dwupodstawione pochodne benzenu, ich polarność rozpatruje się w sposób następujący:
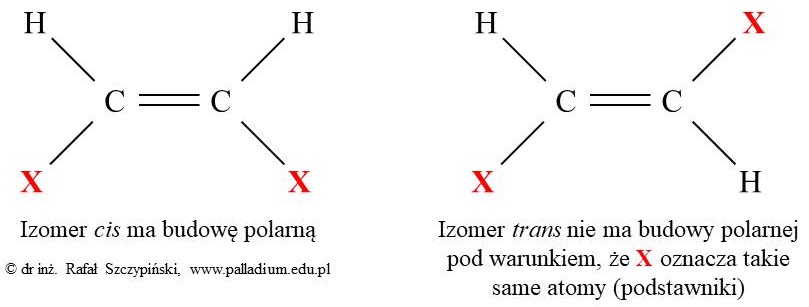
Polarność cząsteczek zawierających dwupodstawiony pierścień benzenu rozpatruje się w sposób następujący:

W przypadku każdego innego ułożenia podstawników (X) – na przykład orto czy meta, lub jeśli nie są one takie same, wówczas mówimy o cząsteczce, która ma budowę polarną. Ponadto należy pamiętać, że cząsteczka benzenu (sam pierścień aromatyczny) nie ma budowy polarnej.
Mam nadzieję, że teraz nie będziesz mieć już problemów z określeniem, czy dana cząsteczka ma budowę polarną, czy też nie jest dipolem elektrycznym. Możesz sprawdzić swoją wiedzę rozwiązując kilka zadań obejmujących to zagadnienie: zadanie 1, zadanie 2, zadanie 3, zadanie 4.
Dane dotyczące wartości momentu dipolowego cząsteczki chlorowodoru pochodzą z podręcznika P. Atkins, L. Jones, Chemia ogólna. Cząsteczki, materia, reakcje, Warszawa 2018.
Spodobał Ci się ten artykuł? Polub mój fanpage na Facebooku oraz na Instagramie, aby nie ominęły Cię żadne nowości.
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Bardzo fajny artykuł, dziękuję
Cieszę się, że się podoba 🙂
a co z takimi czasteczkami jak np CH2Cl2 jak je rozpatrywac i skad wiedziec jaka maja budowe?
Zostało to wyjaśnione w artykule i kryje się w tym jego fragmencie: „Gdyby w którymkolwiek z wyżej narysowanych modeli zamienić jeden (lub kilka) z ligandów na inny (albo na wolną parę elektronową), wówczas cząsteczka taka będzie mieć budowę polarną.”
To czemu chloroform jest niepolarny?
A skąd taka informacja? Moment dipolowy cząsteczki tego związku chemicznego wynosi 1.01 D, a zatem więcej niż zero. Myślę, że chodzi Ci o to, że czasem potocznie mówi się, że coś jest rozpuszczalnikiem niepolarnym/polarnym. Tutaj chodzi wtedy o to, że w rozpuszczalnikach niepolarnych substancje hydrofobowe rozpuszczają się wtedy lepiej niż hydrofilowe. Proponuję zapoznać się z poniższym artykułem, aby łatwiej było Ci zrozumieć o co w tym wszystkim chodzi:
https://palladium.edu.pl/podobne-niezawsze-rozpuszcza-podobne/
Czy HgCl2 jest polarny czy niepolarny?
Nie ma budowy polarnej – jest cząsteczką liniową, podobnie jak CO₂