29.12.2024 | 0 komentarze

W poniedziałek 16 grudnia wielu z was, w ramach przygotowań do do egzaminu maturalnego z chemii rozwiązało zadania z arkusza diagnostycznego CKE 2024. Poczuliście nieco klimatu majowego egzaminu, który napiszecie już za niespełna 5 miesięcy. Czy warto było? Z pewnością, ponieważ egzaminy próbne, choć przeprowadzane są stosunkowo wcześnie, to jednak pozwalają w pewnym stopniu pokazać Wam wszelkie braki w posiadanej wiedzy. Dla niektórych osób mogą być wręcz kubłem zimnej wody wylanym na głowę wskazując, że to już ostatni moment, aby na poważnie przysiąść do nauki… Również i ja chwyciłem za długopis i rozwiązałem arkusz, zamieszczając następnie moją pracę w mediach społecznościowych – na TikToku. Z kolei filmy z omówieniem każdego z zadań znajdziesz tutaj.
Ostatnia próbna diagnoza CKE przeprowadzona została w grudniu 2022 roku. Co mogę powiedzieć o tegorocznej? Zadania zostały opracowane w taki sposób, aby ich tematyka obejmowała okrojone o 20% wymagania egzaminacyjne i to udało się w stu procentach! Są bardzo dobre, nie wszystkie są trudne, choć część obliczeniowa z pewnością dała w kość licznym maturzystom… Zadania 1.1. oraz 1.2. poruszają typowe na maturze zagadnienie związane z identyfikacją pierwiastka chemicznego. Tego typu zadania zaliczamy do pewniaków, choć stan wzbudzony atomu nie dla każdego maturzysty jest czymś oczywistym… Na platformie poruszam ten temat na przykładzie atomu chloru w lekcji związanej z konfiguracjami elektronowymi pierwiastków. Idąc dalej podczas rozwiązywania arkusza, to zadanie 2. przykuło moją szczególną uwagę. Na podstawie narysowanych konturów orbitali (choć poprawniej byłoby stwierdzić, że jest to rozkład prawdopodobieństwa znalezienia elektronu) należało określić liczbę kwantową jaka je różnicuje. Popatrzmy na treść zadania oraz materiały dostępne na platformie:
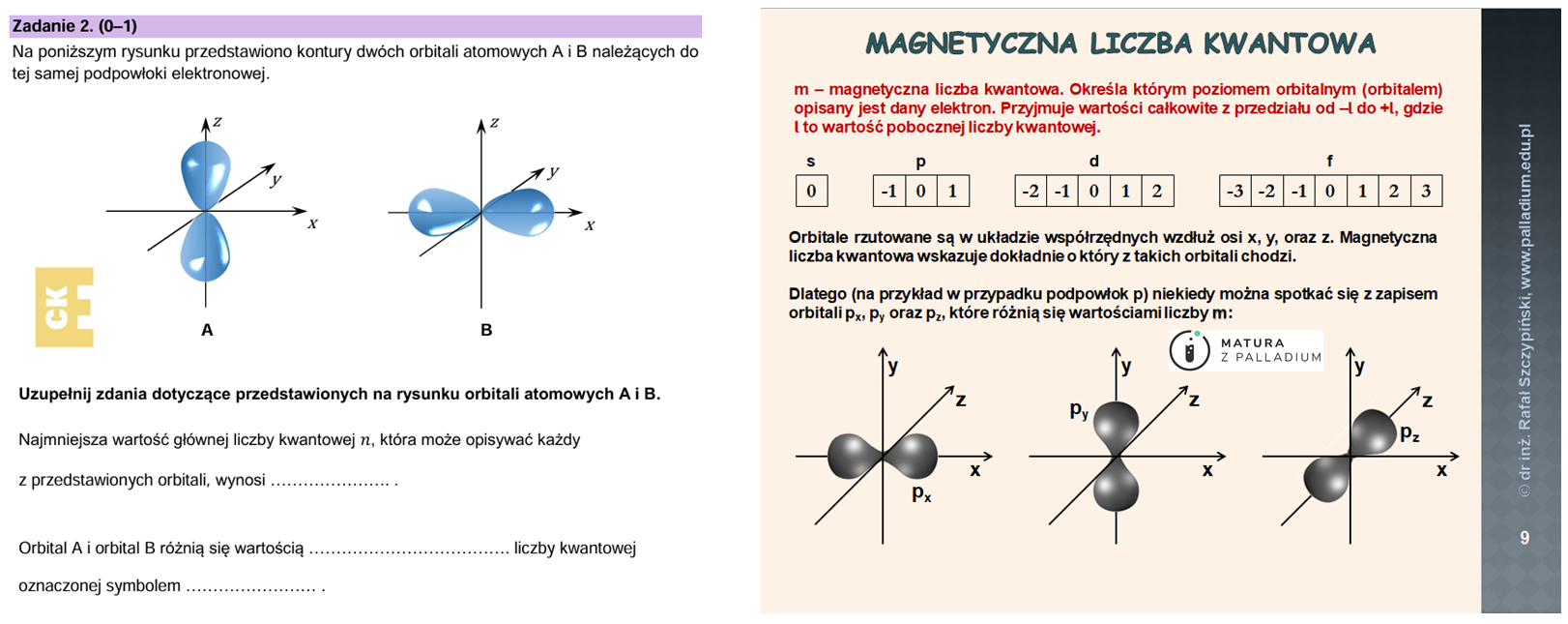
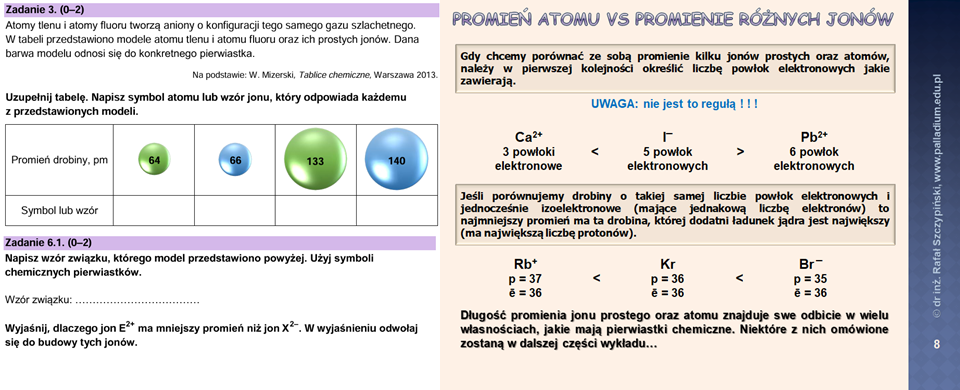
W zadaniu 5. natomiast najpierw należało ustalić symbol nuklidu ulegającego przemianie beta minus, a następnie wykorzystać tę wiedzę w zapisie równania reakcji jądrowej. To wszystko omawiam w lekcji związanej z nuklidami. Z kolei w zadaniu 3. należało przypisać wartości promieni atomowych oraz jonowych do odpowiednich drobin – atomów tlenu oraz fluoru jak również odpowiadających im jonów – tlenkowego oraz fluorkowego. Do tego zadanie 6.1. W jaki sposób trzeba było podejść do rozwiązania tych zagadnień? Z pewnością wiedzieli wszyscy Ci, którzy oglądali lekcję związaną z układem okresowym pierwiastków chemicznych oraz omówionymi w niej wielkościami zmieniającymi się w zależności od położenia pierwiastka w układzie okresowym – były to slajdy 7. (pozwalające rozwiązać zadanie 3.) oraz 8. (z tych dwóch poniżej zamieszczam slajd 8. oraz znajdujące się na nim w centralnej części wyjaśnienie stanowiące odpowiedź do zadania 6.1.):
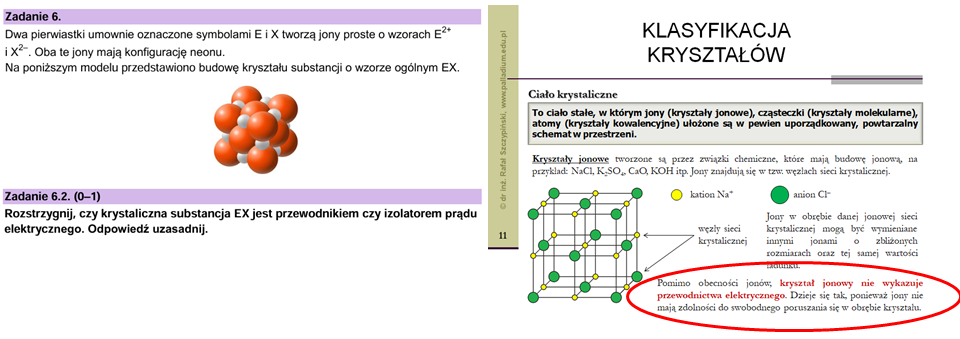
Popatrzmy jeszcze na zadanie 6.2. Wyjaśnienie do niego znajdziecie w lekcji związanej z wiązaniami chemicznymi oraz kryształami. Zwróćcie szczególną uwagę na to, co zaznaczyłem czerwoną elipsą – tak, tu znajduje się odpowiedź do naszego zadania CKE!
Na pierwszy rzut oka zadanie 7. mogłoby wydawać się trudne do rozwiązania, ale czy na pewno? Popatrzmy na zadanie 14. z arkusza testowego (marzec 2022). Różnica między tymi zadaniami polega na tym, że w grudniowym arkuszu objętość w stanie równowagi należało policzyć, natomiast arkuszu z marca była już podana…
Zadanie 7.2. z kolei dotyczyło reakcji równowagowej oraz wpływu zwiększenia temperatury na jej szybkość i ilość substratu w mieszaninie poreakcyjnej. Jest to tak klasyczne zadanie związane z kinetyką reakcji oraz regułą przekory, że praktycznie każdy maturzysta powinien rozwiązać je bezbłędnie. Wpływ zwiększenia temperatury na szybkość ustalenia się stanu równowagi oraz wydajność reakcji omawiam w lekcjach związanych z tematem VI.
Nieco problemów mogło sprawić zadanie 8., a w szczególności ustalenie wykładników potęg w równaniu kinetycznym. Jednak i w tym przypadku użytkownicy platformy PALLADIUM gdzieś już widzieli wykres zależności szybkości reakcji trzeciego rzędu od stężenia substratu:

Dlaczego nie może to być reakcja I rzędu względem reagenta Y? Ponieważ jej szybkość rośnie wprost proporcjonalnie względem stężenia substratu, a jak widzimy w zadaniu 8. – mamy do czynienia z fragmentem wykresu funkcji wykładniczej. Ponieważ przebieg krzywej jest podobny dla reakcji II oraz III rzędu, należy ustalić wartość stałej szybkości reakcji dla każdej z tych rzędowości, wybierając dwa punkty pomiarowe leżące na krzywej. Znając wartość stężenia molowego substratu i odpowiadającej mu szybkości chwilowej zakładamy daną rzędowość reakcji (tu: II) i liczymy dla każdego z tych punktów wartość k. Jeśli policzone wartości różnią się (a różnią w tym przypadku), wówczas sprawdzamy rzędowość III. Jak się okazuje – policzone wartości k są wówczas takie same… Możemy posłużyć się tym sposobem, ponieważ stała szybkości reakcji nie zależy od stężeń substratów. Co do rzędowości względem reagenta X – wykładnik potęgi a ma wartość 0, ponieważ stężenie reagenta X nie wpływa na szybkość reakcji, a zatem dowolna wartość stężenia molowego podniesiona do potęgi o wykładniku zero daje wartość 1. Co do drugiej części zadania – należy rozważyć jak zmiana pojemności naczynia (a zatem objętości przestrzeni reakcyjnej) wpływa na stężenie gazowego substratu. Z pomocą przychodzi wzór opisujący stężenie molowe, z którego wynika, że wraz ze wzrostem objętości stężenie molowe maleje, a w konsekwencji maleje również szybkość reakcji.
Fotografie związane z zadaniem 9. dostępne są na platformie Palladium pod kafelkiem Fotografie odczynników z opisem w temacie Związki miedzi na II stopniu utlenienia, a opisane reakcje chemiczne omówione zostały podczas lekcji TEMAT III. Wykład: chemia nieorganiczna, część 3 – wodorotlenki i zasady (slajdy 6. oraz 19.). Do tego w wydanym przeze mnie zbiorze zadań oraz na platformie możemy spotkać takie oto zadanie:

Zadanie 10.1. dotyczyło ustalenia wzoru tlenku na podstawie procentu masowego żelaza. Jest to jedno z najbardziej powszechnych typów zadań związanych z ustalaniem wzorów związków chemicznych – znajduje się ono również na platformie, jak i w moim zbiorze zadań maturalnych (zadanie 15. w rozdziale 1.1) i pomimo, że dotyczy tlenku siarki, to sam mechanizm rozwiązania jest dokładnie taki sam:

Z kolei, aby rozwiązać zadanie 10.2., gdy rozszyfrowany został wzór tlenku wystarczyło tylko dokładnie przeczytać informację wstępną do zadania oraz wykorzystać wiedzę dotyczącą bezbarwnego gazu, który zapala się wybuchowo. Jest to oczywiście wodór, któremu poświęcona jest lekcja związana z tym pierwiastkiem chemicznym oraz jego związkami – wodorkami. Mowa o jego właściwościach wybuchowych jest w slajdzie nr 4.
W celu rozwiązania zadania 11.1. oraz zadania 11.2. należało wykazać się nie tylko umiejętnością zapisu równania reakcji spalania całkowitego, ale również znajomością pojęcia jakim jest entalpia spalania, o której wspominam podczas części 1. wykładu dotyczącego termodynamiki:

Ponadto należało zauważyć, że energia cieplna wydzielona w wyniku spalenia butan-1-olu jest równa energii pochłoniętej przez wodę, co doprowadziło do ogrzania tej substancji. Mówimy wówczas o przepływie energii cieplnej z otoczenia do układu (woda). A czym jest układ oraz otoczenie oraz jakie rozróżniamy rodzaje układów termodynamicznych omawiam podczas tej samej lekcji, z której pochodzą powyższe dwa slajdy. Z kolei przykłady reakcji spalania (w tym całkowitego) omawiam już podczas lekcji związanej z węglowodorami nasyconymi.
Aby poprawnie rozwiązać zadanie 12. wystarczyło dokładnie zapoznać się z tematem równowag w roztworach wodnych, a ściślej mówiąc ze sposobem usuwania przemijającej twardości wody, czemu poświęcam nie tylko jeden ze slajdów, ale również cały artykuł – Usuwanie przemijającej twardości wody oraz składniki powstającego kamienia kotłowego. Popatrzcie:

W celu rozwiązywania zadania 13. niewątpliwie przydała się wiedza z matematyki lub po prostu kalkulator naukowy, w celu przeliczenia (choć nie jest to konieczne) wartości pKs na Ks, a następnie interpretacji uzyskanych wyników. Z kolei w zadaniu 14. należało nie tylko wykazać się wiedzą z zakresu reakcji związków nieorganicznych – w tym ich kolejności, bowiem wprowadzając do wodnego roztworu kwasu tlenek zasadowy reagujący zarówno z wodą jak i z kwasem, najpierw przereaguje on z kwasem, a dopiero ewentualny nadmiar tlenku przereaguje z wodą. Ponadto w treści zadania wyraźnie zaznaczono, że tlenek CaO roztworzył się całkowicie, jednak wiele osób nie doczytało tej istotnej informacji i rozwiązało je stosując iloczyn rozpuszczalności wodorotlenku wapnia. Był to oczywiście błąd, ponieważ mieszanina poreakcyjna stanowiła klarowny roztwór…
Zadania z barwnymi fotografiami odczynników na dobre wpisały się w kanon matury z chemii. Pierwsze zadanie tego typu ma numer 15 i składało się z dwóch podpunktów. Najpierw należało rozwiązać zadanie 15.1., rozszyfrowując uprzednio zawartość czterech probówek, korzystając nie tylko z zamieszczonych fotografii, ale również z danych zawartych w tablicach CKE dotyczących wskaźników alkacymetrycznych. Ponadto należało wykazać się znajomością pojęcia hydrolizy soli w wodnych roztworach takich związków chemicznych. Opisanemu procesowi poświęcam kilka slajdów w lekcji związanej z solami (Temat IV). Z kolei zadanie 15.2. to najbardziej klasyczne zastosowanie teorii Brønsteda, w celu wyjaśnienia odczynu wodnego roztworu soli (w tym przypadku – węglanu sodu). Z tym równaniem procesu spotykamy się wielokrotnie w materiałach PALLADIUM.
Dotarliśmy w ten sposób do połowy arkusza grudniowej diagnozy, w którym kolejne zadanie związane jest z blaszkami. W zadaniu 16.1. należało policzyć masę płytki po zakończeniu doświadczenia. Jak się okazuje dość podobne zadanie znajduje się nie tylko na platformie (dokładnie tutaj), ale również w zbiorze moich autorskich zadań (rozdział 6.2., zadanie 3.).

W zadaniu 16.2. należało ocenić poprawność zamieszczonych zdań. W przypadku pierwszego z nich należało najpierw policzyć (na podstawie danych w tablicach CKE) wartość SEM i porównać z wartością podaną w treści zdania. Z kolei drugie zdanie dotyczyło przemieszczania się jonów w obrębie klucza elektrolitycznego podczas pracy ogniwa, co wyjaśniam w lekcji dotyczącej ogniw chemicznych na przykładzie ogniwa Daniella. Aby rozwiązać zadanie 17. należało pamiętać o pewnych zależnościach. Jakich? Wyjaśniam w tej samej lekcji, jak poprzednio:

Popatrzmy teraz na zadanie 18.1. oraz zadanie 18.2. otwierające chemię organiczną. Chwila, gdzieś już nazywaliśmy ten węglowodór! Zgadza się – jest to jeden z izomerów heks-1-ynu, na przykładzie którego omawiam izomerię konstytucyjną w alkinach:
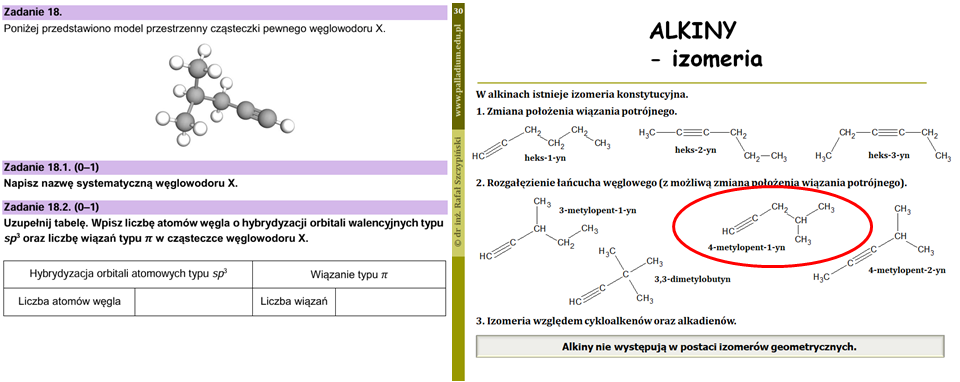
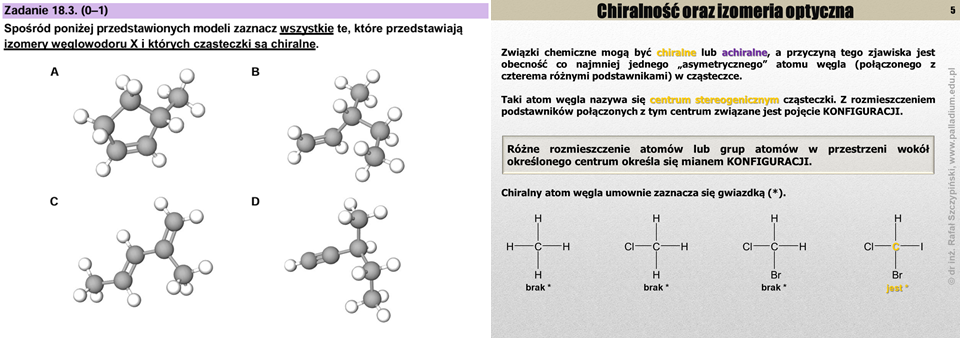
No dobrze, ale przecież nikt na pamięć nie będzie się uczył nazw związków organicznych. Oczywiście, że nie – jest na to inne rozwiązanie – nauczyć się zasad nazewnictwa takich substancji. A z tym mamy do czynienia w każdym temacie z zakresu chemii organicznej, w którym omawiam jest dany rodzaj szeregu homologicznego. Z kolei przypisywanie typu hybrydyzacji orbitalom walencyjnym atomu oraz określanie liczby wiązań π to jest już swego rodzaju pewniaki maturalne, którym poświęciłem przynajmniej kilkanaście zadań zamieszczonych na platformie PALLADIUM. Jedną z lekcji poświęciłem izomerii optycznej, do której nawiązuje zadanie zadanie 18.3. Z jego rozwiązaniem nie powinni mieć żadnych problemów ci uczniowie, którzy znają pojęcie chiralności cząsteczek oraz izomerii optycznej i konstytucyjnej.
Rozwiązaniem zadanie 19. jest najzwyklejsze równanie reakcji synproporcjonacji, z którym w pewnym sensie spotkaliśmy się już kiedyś w arkuszu CKE, a dokładniej w maju 2017 roku, w zadaniu 27.1. Przy czym tym razem należało napisać pełne równanie reakcji chemicznej, a nie tylko równania reakcji połówkowych. Pomarańczowe zabarwienie to oczywiście powstały w wyniku tej przemiany brom, a zatem mamy do czynienia z utworzeniem wody bromowej.
W zadaniu 20. mamy do czynienia z porównaniem rozpuszczalności bromu w wodzie oraz toluenie, co możemy wnioskować na podstawie zamieszczonych fotografii zmiany intensywności zabarwienia odpowiednich faz – organicznej oraz nieorganicznej. Z kolei proces o którym mowa jest w zadaniu to oczywiście ekstrakcja (omawiana Temacie I – metodach rozdziału mieszanin), którą wykorzystuje się z uwagi na lepszą rozpuszczalność bromu w toluenie niż w wodzie. Dlaczego tak się dzieje, że dana substancja lepiej rozpuszcza się w konkretnym rozpuszczalniku omawiam w lekcji z Tematu V – stężeniach i rozpuszczalności.
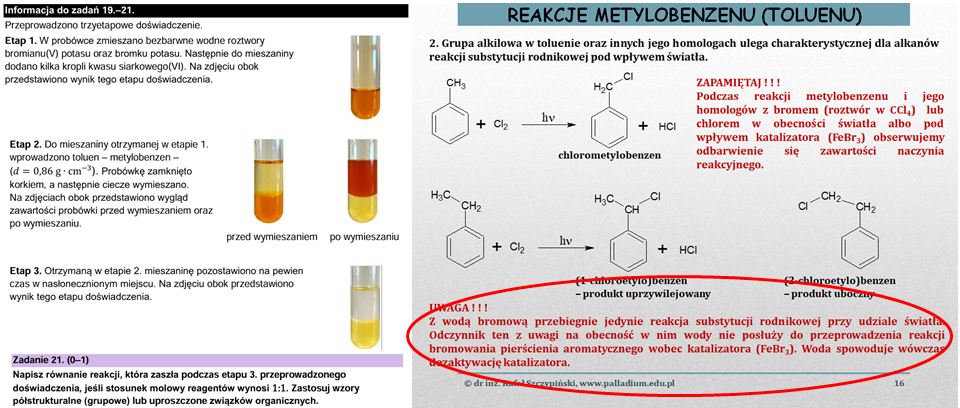
Zadanie 21. sprawdza znajomość reakcji toluenu z bromem w określonych warunkach jej prowadzenia. Można tutaj było strzelić gafę i napisać równanie reakcji bromowania pierścienia aromatycznego. Taki proces jednak tutaj nie zachodzi. A dlaczego? Wyjaśniam w lekcji związanej z węglowodorami aromatycznymi:
Każdy, kto solidnie opanował lekcję z zakresu polimerów, z pewnością nie będzie miał problemu z rozwiązaniem zadania 22. Podobnie sytuacja wygląda w przypadku kolejnego – zadania 23.1., w którym należało ocenić poprawność zdań dotyczących reakcji addycji bromowodoru do 2-metylopropenu na podstawie przedstawionego schematycznie mechanizmu reakcji oraz krzywej profilu energetycznego reakcji. Odpowiedź na 1. oraz 2. zdanie kryje się w lekcjach (odpowiednio) kinetyka chemiczna (slajd 6.) oraz węglowodory nienasycone (slajd 14. – pełny opis mechanizmu addycji elektrofilowej bromowodoru do propenu). A który etap procesu przebiega szybciej? Oczywiście ten, którego energia aktywacji jest mniejsza, a problem taki poruszono w zadaniu 23.2.
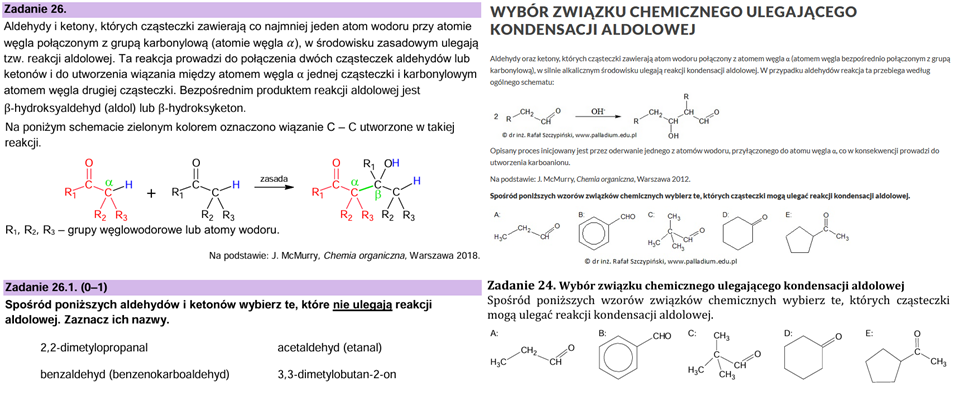
Przyjrzyjmy się teraz zadaniu 24. oraz temu, co znajduje się w lekcji dotyczącej aldehydów i ketonów:

Dlaczego w ciekłym propanonie między jego cząsteczkami nie tworzą się wiązania wodorowe? Temat ten wałkowany był już wielokrotnie, ale przypominam o nim za każdym razem, kiedy nadarzy się okazja – nie tylko w lekcji dotyczącej budowy cząsteczek i wiązań chemicznych, ale i w licznych artykułach, jakie znajdziesz w dziale blog platformy PALLADIUM, na przykład w Podobne (nie)zawsze rozpuszcza podobne. Z kolei odpowiedź do zadania 25. znajdziesz na slajdzie 17. oraz slajdzie 20. tej samej lekcji, w której omawiam otrzymywanie ketonów. Co ciekawe – reakcję otrzymywania acetonu z alkoholu omawiam aż dwukrotnie – pierwszy raz w reakcjach alkoholi II-rzędowych, a drugi – w przypadku otrzymywania ketonów.
No dobrze. Przejdźmy teraz do zadania 26.1., ponieważ tutaj pojawiło się coś ciekawego. Zerknijcie na moje autorskie zadanie z platformy, które znajduje się również w drukowanym zbiorze zadań (zadanie 24, rozdział 7.3.). Co ciekawe, akurat to zadanie dostępne jest z pełnym filmowym omówieniem bezpłatnie:
To jeszcze nie wszytko. Zerknijmy do treści zadania 26.2. i porównajmy ją z kolejnym zadaniem na platformie oraz w zbiorze zadań (zadanie 26, rozdział 7.3.):
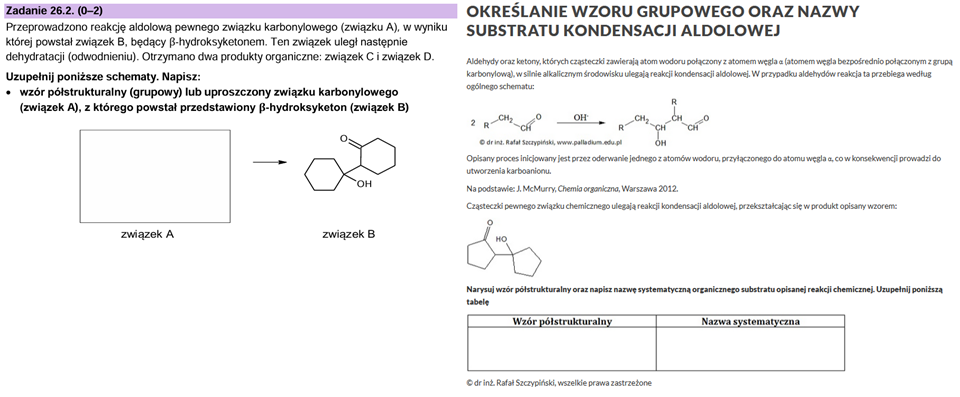
Jak widać zadania są bardzo podobne…
Kolejne zadanie dotyczyło reakcji kwasu mrówkowego z alkaliczną zawiesiną wodorotlenku miedzi(II). Tak się składa, że to doświadczenie dostępne jest również w postaci nagranego filmu wraz z omówieniem. Zatem, aby rozwiązać zadanie 27. wystarczyło dokładnie przeanalizować przebieg eksperymentu (rodzaj powstającego produktu), a następnie wykazać się umiejętnością narysowania wzoru anionu mrówczanowego. Film z opisanym eksperymentem znajdziesz w kafelku Doświadczenia chemiczne na filmach. Poniżej, obok treści zadania z arkusza zamieściłem kadr z tego filmu:

A sposób rysowania wzoru elektronowego kreskowego jonu złożonego przedstawiam w tutorialu Rysowanie wzorów elektronowych jonów złożonych.
W ten sposób dotarliśmy do zadania 28., w którym mamy do czynienia z reakcją hydrolizy zasadowej estru – octanu fenylu. Ponieważ jest to ester stanowiący pochodną fenolu oraz kwasu karboksylowego, należało pamiętać, że w opisanych warunkach powstaje mieszanina dwóch soli – fenolanu oraz octanu i dodatkowo woda. Popatrzmy teraz na jedno z zadań znajdujące się na platformie PALLADIUM oraz w zbiorze drukowanym (zadanie 33, rozdział 7.4.), a ściślej mówiąc na odpowiedź do niego:

Wierzę, że jeśli ktoś rozwiązał podobne do zadania 28. zadanie z platformy, z pewnością nie miał nawet najmniejszych problemów z rozwiązaniem tego w arkuszu CKE!
Rozwiązanie zadanie 29. (tak, tego z kwasem asparaginowym) przerosło liczne grono uczniów, ale i nauczycieli! A wystarczyło tylko pamiętać o kolejności reakcji słabych kwasów z zasadami. Omawiam ten problem podczas lekcji Równowagi w roztworach wodnych – część 1. , a na konkretnym przykładzie – kwasie salicylowym podczas lekcji Kwasy karboksylowe:
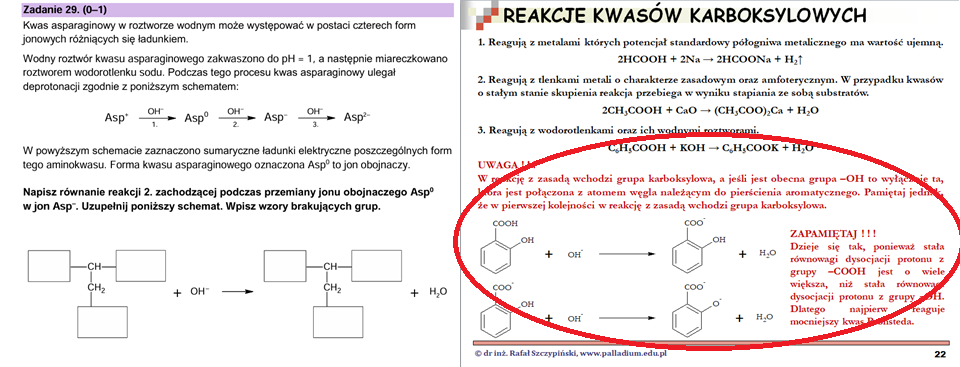
Najpierw oczywiście należało poprawnie narysować wzór jonu obojnaczego powstałego z formy kationowej aminokwasu. Tutaj również korzystamy z reguły o której wspominam powyżej… A jak wygląda struktura cząsteczki kwasu asparaginowego dowiadujemy się z tablic CKE.
Zadanie 30. łączy w sobie wiadomości z zakresu stechiometrii wzorów chemicznych oraz prawa zachowania masy, jak również budowy peptydów. Jest to jedno z tych zadań, które podobają mi się najbardziej w tym arkuszu! Z pewnością wielu uczniów miało problemy z jego rozwiązaniem, choć tak naprawdę nie jest aż tak skomplikowane na jakie wygląda…
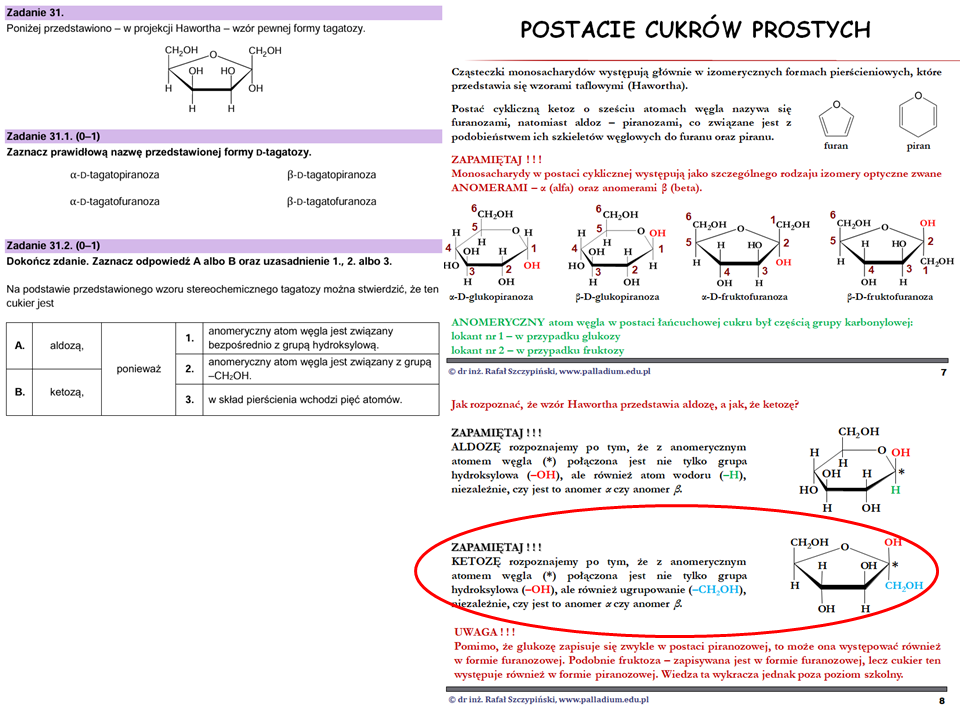
Ostatnie dwa zadania dotyczyły monosacharydu. W zadaniu 31.1. należało wskazać jego poprawną nazwę. W tym celu uczeń musiał wykazać się znajomością określania typu anomeru (alfa lub beta) oraz jego przynależności do furanoz oraz piranoz. Z kolei w zadaniu 31.2. należało przypisać przedstawioną wzorem Hawortha tagatozę do aldoz lub ketoz. To wszystko omawiam w lekcji związanej z cukrami:
Przemyślenia na temat tego arkusza oraz samej analizy pozostawiam Tobie, jednak analizując wszystko to, co pojawiło się w tegorocznej diagnozie oraz we wcześniejszych arkuszach CKE uważam, że sumienna praca z materiałami Palladium pozwoli Ci osiągnąć satysfakcjonujący wynik w maju.
A co myślę na temat samych zadań? W mojej opinii jest to jeden z lepszych arkuszy, jakie opublikowane zostały przez Centralną Komisję Egzaminacyjną. Możesz poświęcić kilka minut i obejrzeć film na TikToku, w którym dzielę się moimi spostrzeżeniami.
Spodobał Ci się ten artykuł? Polub mój fanpage na Facebooku oraz na Instagramie, aby nie ominęły Cię żadne nowości.
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone