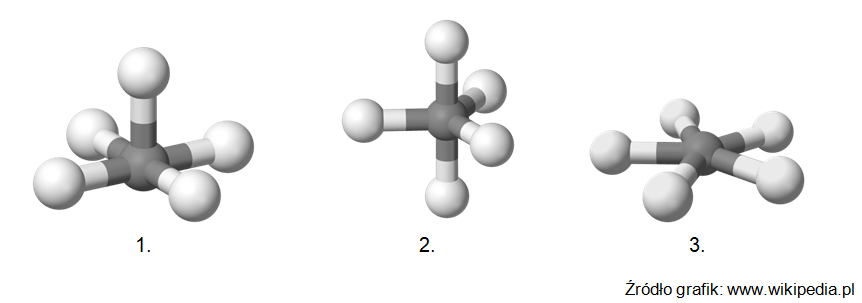
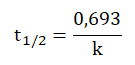Wybór właściwego enzymu katalizującego proces przekształcania aldehydu 3-fosfoglicerynowego w 1,3-bisfosfoglicerynian
Jednym z procesów biegnących podczas glikolizy jest reakcja w wyniku której dochodzi do przekształcenia aldehydu 3-fosfoglicerynowego w 1,3-bisfosfoglicerynian (1,3-BPG), a katalizuje ją pewien enzym X:
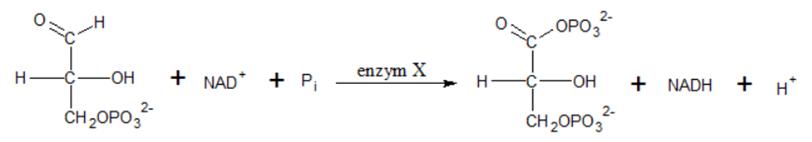
Na podstawie: J. M. Berg, L. Stryer, J. L. Tymoczko, G. J. Gatto, Biochemia, Warszawa 2019.
Wśród nazw wymienionych enzymów podkreśl tę, która odpowiada enzymowi X biorącemu udział w opisanym procesie: a) Izomeraza triozofosforanowa. b) Fosfofruktokinaza. c) Dehydrogenaza aldehydu 3-fosfoglicerynowego. d) Karboksykinaza fosfoenolopirogronianowa. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Związki zawierające chrom na VI stopniu utlenienia
Tlenek chromu(VI), chromiany oraz dwuchromiany(VI)
Fotografie z dokładniejszym opisem dostępne są po wykupieniu dostępu do platformy.
Spis wszystkich lekcji wykładowych platformy PALLADIUM
Poniżej znajdziesz linki do poszczególnych poukładanych chronologicznie lekcji z chemii. Zaproponowana kolejność przyswajania materiału pozwoli Ci lepiej usystematyzować wiedzę z uwagi na ścisłe powiązania między poszczególnymi działami. Aby wejść do wybranej lekcji kliknij interesujący Cię temat zapisany czcionką w kolorze zielonym. Dodatkowe lekcje tematyczne znajdują się na końcu spisu.
Mol, masa molowa, mieszanina i związek chemiczny
TEMAT I. Wykład: stechiometria, część 1 – podstawowe zależności
TEMAT I. Wykład: stechiometria, część 2 – mieszaniny i związki chemiczne
Atom, cząsteczka, układ okresowy pierwiastków chemicznych
TEMAT II. Wykład: podstawy chemii, część 1 – budowa układu okresowego pierwiastków chemicznych
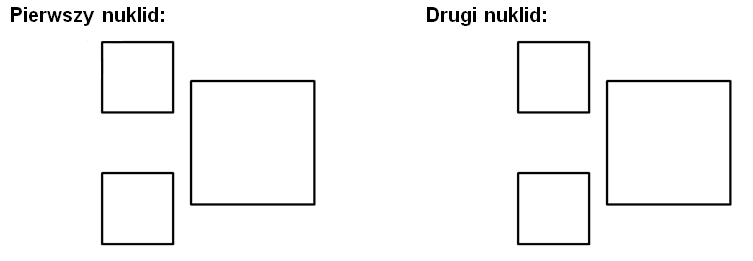
TEMAT II. Wykład: podstawy chemii, część 2a – budowa atomu – nuklidy
TEMAT II. Wykład: podstawy chemii, część 3b – hybrydyzacja, budowa przestrzenna drobin
Chemia pierwiastków bloków s oraz p
TEMAT III. Wykład: chemia nieorganiczna, część 1 – wodór oraz wodorki pierwiastków bloków s i p
TEMAT III. Wykład: chemia nieorganiczna, część 2 – tlen oraz tlenki pierwiastków bloków s, p i d
TEMAT III. Wykład: chemia nieorganiczna, część 3 – wodorotlenki i zasady
TEMAT III. Wykład: chemia nieorganiczna, część 4 – kwasy
TEMAT IV. Wykład: sole oraz procesy hydrolizy w ich wodnych roztworach
Stężenie oraz rozpuszczalność substancji
TEMAT V. Wykład: woda, roztwory wodne, stężenie i rozpuszczalność substancji
Termodynamika oraz statyka chemiczna
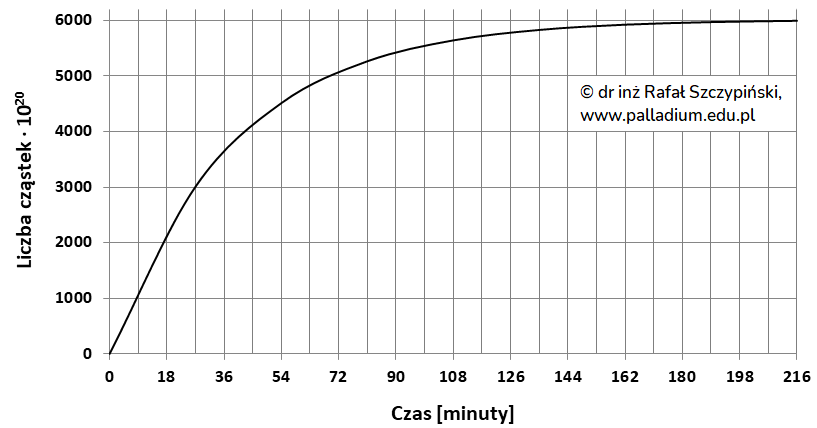
TEMAT VI. Wykład: termodynamika oraz statyka reakcji chemicznych, część 2 – kinetyka chemiczna
Równowagi w roztworach wodnych
Procesy redoks, pierwiastki bloku d
TEMAT VIII. Wykład: procesy redoks, część 1 – reakcje redoks, bilans jonowo-elektronowy
TEMAT VIII. Wykład: procesy redoks, część 2 – pierwiastki bloku d
TEMAT IX. Wykład: elektrochemia, część 1 – półogniwa i ogniwa chemiczne, korozja elektrochemiczna
TEMAT IX. Wykład: elektrochemia, część 2 – elektroliza
Chemia organiczna
TEMAT X. Wykład: wstęp do chemii związków organicznych
TEMAT X. Wykład: węglowodory, część 1 – alkany oraz cykloalkany, węglowodory nasycone
TEMAT X. Wykład: węglowodory, część 2 – alkeny oraz alkiny, alifatyczne węglowodory nienasycone
TEMAT X. Wykład: węglowodory, część 3 – węglowodory aromatyczne
TEMAT XI. Wykład: halogenopochodne węglowodorów
TEMAT XII. Wykład: hydroksylowe pochodne węglowodorów, część 1 – alkohole
TEMAT XII. Wykład: hydroksylowe pochodne węglowodorów, część 2 – fenole
TEMAT XIII. Wykład: aldehydy i ketony
TEMAT XIV. Wykład: kwasy karboksylowe
TEMAT XV. Wykład: mydła, estry, tłuszcze
TEMAT XVI. Wykład: aminy i amidy
TEMAT XVII. Wykład: izomeria optyczna
TEMAT XVIII. Wykład: polimery i tworzywa sztuczne
TEMAT XIX. Wykład: biocząsteczki, część 1 – aminokwasy, peptydy, białka
TEMAT XIX. Wykład: biocząsteczki, część 2 – cukry, glikozydy
TEMAT XX. Wykład: podstawy spektroskopii oraz widma
Dodatkowe lekcje tematyczne:
Wykład: struktura cząsteczki związku organicznego a temperatura wrzenia
Wykład: przewidywanie kierunku przebiegu reakcji chemicznej
Wykład: odróżnianie oraz identyfikacja substancji chemicznych
Związki zawierające mangan na II stopniu utlenienia
Sole manganu(II), wodorotlenek manganu(II)…
Fotografie z dokładniejszym opisem dostępne są po wykupieniu dostępu do platformy.
Związki zawierające mangan na IV stopniu utlenienia
Wodna zawiesina tlenku manganu(IV)…
Fotografie z dokładniejszym opisem dostępne są po wykupieniu dostępu do platformy.
Związki zawierające mangan na VI stopniu utlenienia
Świeżo uzyskany roztwór manganianu(VI) potasu…
Fotografie z dokładniejszym opisem dostępne są po wykupieniu dostępu do platformy.
Związki zawierające mangan na VII stopniu utlenienia
Wodny lub zakwaszony roztwór manganianu(VII) potasu oraz krystaliczny manganian(VII) potasu
Fotografie z dokładniejszym opisem dostępne są po wykupieniu dostępu do platformy.