Liczbę równocennych grup atomów wodoru w cząsteczkach związków organicznych (na przykład węglowodorów) można określić na podstawie spektroskopii magnetycznego rezonansu jądrowego (NMR). Obecna w zarejestrowanym widmie 1H NMR liczba grup sygnałów odpowiada liczbie równocennych atomów wodoru w cząsteczce badanego związku chemicznego. Ponieważ połączone z sąsiadującymi ze sobą atomami węgla atomy wodoru mogą oddziaływać wzajemnie, bardzo często zdarza się zaobserwować obejmujące pewien zakres przesunięcia chemicznego (δ, ppm) rozszczepienie sygnałów. Na rysunku przedstawiającym widmo 1H NMR uwidacznia się to przylegającymi do siebie różnej wysokości pikami. Na przykład propan ma dwie grupy równocennych atomów wodoru. Pierwszą z nich stanowią te, obecne w grupach –CH3, druga natomiast to te, znajdujące się w ugrupowaniu –CH2–. Rysunek poniżej ilustruje widmo 1H NMR opisanego alkanu, na którym literami A i B oznaczono grupy sygnałów reprezentujących równocenne atomy wodoru:
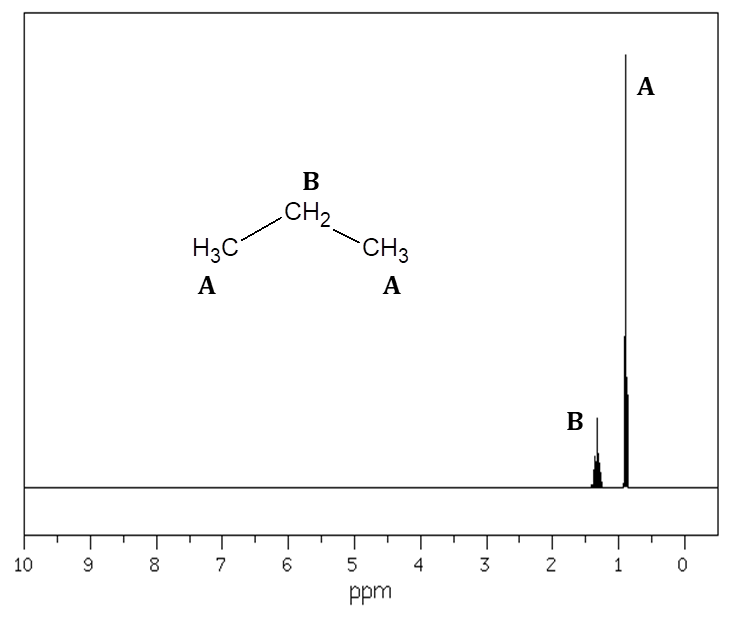
Na podstawie: National Institute of Advanced Industrial Science and Technology, www.sdbs.db.aist.go.jp, dostęp od 2022 roku.
W przypadku, gdy związek chemiczny ma kilka grup równocennych atomów węgla w cząsteczce, w celu ustalenia liczby takich grup można zarejestrować widmo 13C NMR. Obecne w nim sygnały odpowiadają wówczas ilościowo liczbie grup równocennych atomów węgla.
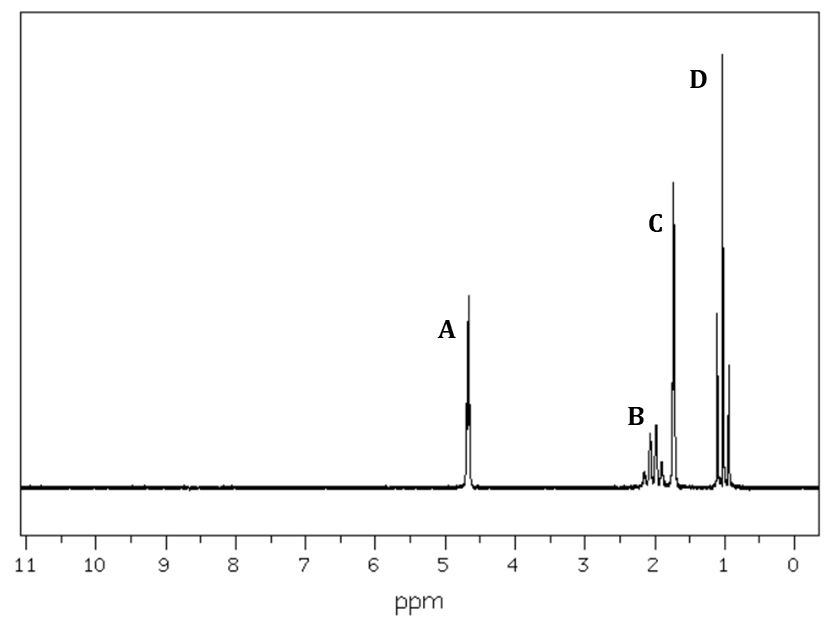
Masa jednego mola cząsteczek pewnego węglowodoru wynosi 70 g. Rysunki poniżej przedstawiają kolejno widma – 13C NMR oraz 1H NMR opisanego związku chemicznego:
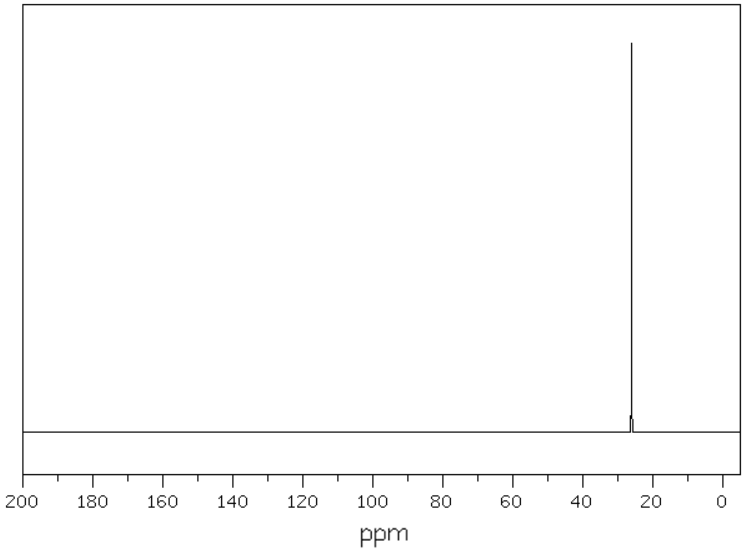
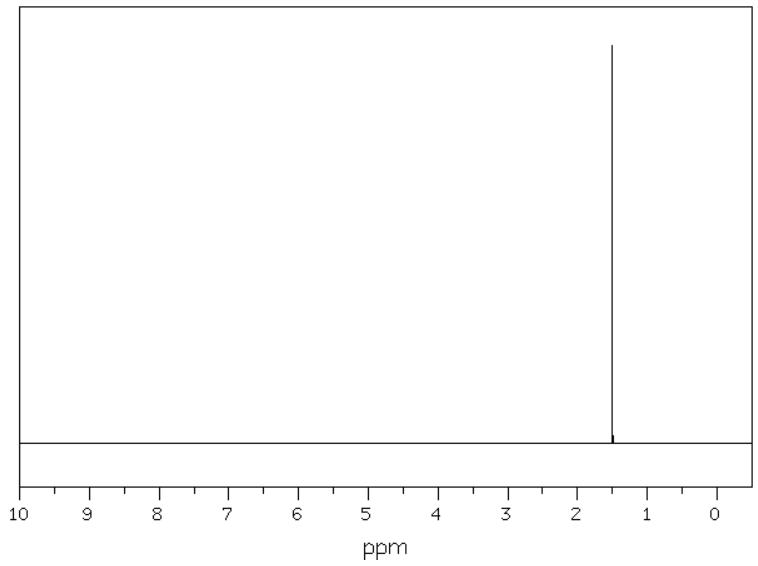
Na podstawie: National Institute of Advanced Industrial Science and Technology, www.sdbs.db.aist.go.jp, dostęp od 2022 roku.
Węglowodór ten poddano następnie monobromowaniu w obecności światła. W zarejestrowanym widmie 1H NMR uzyskanego produktu zaobserwowano trzy sygnały pochodzące od atomów wodoru różniących się otoczeniem chemicznym.
Wykonaj niezbędne obliczenia, a następnie stosując grupowe lub uproszczone wzory związków organicznych, napisz równanie opisanej reakcji monobromowania. Uwzględnij warunki prowadzenia tego procesu.
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone