19.05.2024 | 0 komentarze

Druga odsłona majowej matury 2024 w formule 2023 jest już za nami. Arkusz wzbudził olbrzymie emocje, ponieważ był zdecydowanie trudniejszy niż ubiegłoroczny. Ponadto pojawiły się nowe typy zadań obliczeniowych, jak również mogące sprawić problem zadania związane z uzasadnieniem odpowiedzi. To jednak nie wszystko – w arkuszu pojawiło się również trochę nieścisłości oraz błędów…
Za rozwiązanie zadań z arkusza zabrałem się tradycyjnie chwilę po jego publikacji w Internecie, a zatem w dniu matury, na co poświęciłem nieco ponad 2 godziny. Trwało to to o pół godziny dłużej, niż w przypadku zadań z arkusza majowego CKE z 2023 roku, co zdecydowanie daje do myślenia… Już w trakcie rozwiązywania zadań zauważyłem, że wiele z nich pojawiło się w różnej formie na stronie platformy PALLADIUM. Zacznijmy jednak od początku.
Arkusz tradycyjnie otwiera zadanie związane z odszyfrowaniem symboli pierwiastków chemicznych, którymi w tym roku okazały się być fosfor oraz chrom. W podpunkcie 1.2 wymagano od nas uzupełnienia konfiguracji klatkowej w taki sposób, aby przedstawiała rozmieszczenie elektronów w jonie Cr3+. A teraz popatrzmy na lekcję z tematu II: podstawy chemii, część 2b – budowa atomu – konfiguracje elektronowe pierwiastków oraz liczby kwantowe:

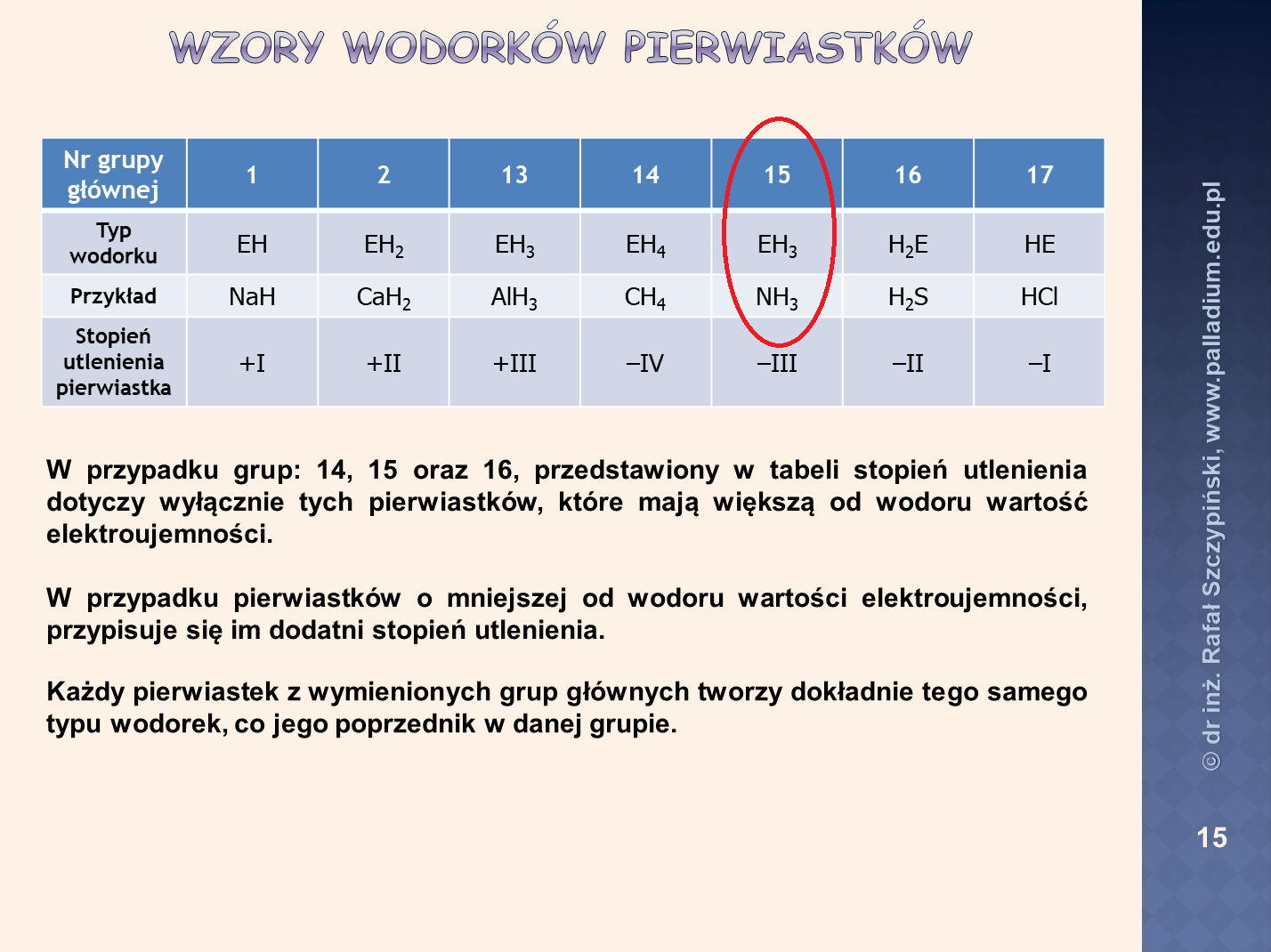
Widzimy omówiony sposób zapisu pełnej konfiguracji elektronowej tego jonu, który wystarczyło tylko przedstawić graficznie (czyli tzw. klatkami Hunda). W kolejnym podpunkcie wymagano od zdającego zapisu wzorów sumarycznych wodorku oraz tlenków pierwiastków jakie zostały rozszyfrowane, przy czym w poleceniu wymagani wykorzystania symboli A oraz X – jakimi umownie oznaczono te pierwiastki. Myślę, że egzaminatorzy nie pogniewają się, jeśli podczas rozwiązania tego zadania zastosowane zostaną symbole chemiczne rozszyfrowanych pierwiastków chemicznych. Wszak polecenie mówi jedno (zastosuj symbole A i X), zaś to, co mamy w tabeli sugeruje, żeby wpisać wzór wodorku pierwiastka A, tlenku pierwiastka A, tlenku pierwiastka X – a zatem konkretnych pierwiastków chemicznych, które opisane zostały w informacji wprowadzającej! W każdym razie i to zadanie ma swoje odbicie w materiałach platformy PALLADIUM. Wzory wodorku oraz tlenków omówione zostały w kilku lekcjach: podstawy chemii, część 1 – budowa układu okresowego pierwiastków chemicznych (wzory wodorków oraz tlenków przy maksymalnym stopniu utlenienia):
procesy redoks, część 2 – pierwiastki bloku d (reakcja tlenku chromu(VI) z zasadą):

chemia nieorganiczna, część 4 – kwasy (reakcja tlenku fosforu(V) z wodą):

Zadanie 2.1. dotyczyło z kolei rozpadu beta minus, a zadanie 2.2. reakcji jądrowej z udziałem protonu. Jak przebiega rozpad beta minus omawiam podczas lekcji podstawy chemii, część 2a – budowa atomu – nuklidy:

Natomiast jak zapisać proton, również przedstawiłem na tym samym slajdzie…
Żeby rozwiązać zadanie 3. wystarczyło z kolei dokładnie przeanalizować treść wstępną, a w zadaniu 4. odpowiedź była wręcz częścią informacji wstępnej do zadań 3. oraz 4. Zadanie 5. z kolei dotyczyło form krystalicznych (kryształy kowalencyjne) tlenku germanu. Należało wskazać liczbę koordynacyjną atomu germanu w jednej ze struktur, a w drugiej – wybrać typ hybrydyzacji orbitali walencyjnych atomu tego pierwiastka. Podpowiedź do pierwszego postawionego pytania znajdowała się w treści wstępnej do tego zadania, natomiast jak określić typ hybrydyzacji orbitali walencyjnych danego atomu – omawiamy podczas lekcji podstawy chemii, część 3b – hybrydyzacja, budowa przestrzenna drobin oraz w kilkudziesięciu różnych zadaniach…
Zadanie 6.1. było pierwszym zadaniem obliczeniowym w tegorocznym arkuszu. Należało wykonać obliczenia, które pozwalają określić, jak zmieniało się stężenie nadtlenku wodoru podczas prowadzonego miareczkowania. Następnie na podstawie policzonych wartości stężeń H2O2 wymagano narysowania wykresu ilustrującego zmiany stężenia molowego tego związku chemicznego w czasie prowadzonego miareczkowania. W mojej opinii zadanie to było o tyle skomplikowane, że, w celu uzupełnienia tabeli niezbędnymi do narysowania wykresu danymi, każdorazowo należało wykonać dość złożone obliczenia, aby przejść ze stężenia roztworu manganianu(VII) potasu na stężenie nadtlenku wodoru. Jest to zupełnie nowy typ zadania jaki pojawił się na maturze z chemii. Za to z uśmiechem na ustach maturzyści powinni spojrzeć na zadanie 7. Dlaczego? Ponieważ ten typ zadania już wcześniej (zadanie 13., maj 2019) pojawił się na maturze, z pewną istotną różnicą – tym razem wprowadzaliśmy roztwór dwuwodorotlenkowej zasady do roztworu kwasu. Zwrócę się teraz do uczestników kursu grupowego – przypomnijcie sobie odnośnie zadania 14.1 z roku 2020 (omówione podczas lekcji na żywo 03.02.2024 roku: reakcje w roztworach wodnych, wskaźniki pH, miareczkowanie, przewodnictwo), co powiedziałem na temat, gdy mamy wodorotlenek dwuzasadowy… Uprzedzałem, abyście wzięli pod uwagę, żeby nie patrzeć na równanie reakcji zapisane w formie jonowej skróconej, ponieważ układ nie osiąga pH = 7. Radziłem w takiej sytuacji zapis równania reakcji w formie cząsteczkowej, aby nie zapomnieć o tej dwójce, która stoi przed wzorem HCl i pojawia się w proponowanym przeze mnie modelu rozwiązania tegorocznego zadania maturalnego, w linijce podpisanej jako nHCl, jaki reaguje: 2∙0,02∙X.
Zadanie 8. to już właściwie klasyka iloczynu rozpuszczalności. Zadajemy pytanie: czy strąci się osad, jeśli zmieszamy roztwory dwóch związków chemicznych? W zasadzie wymagające kilku obliczeń więcej zadanie tego typu możemy znaleźć na platformie PALLADIUM i jednocześnie w II tomie autorskich arkuszy: Zadanie 19. Arkusz Palladium kwiecień 2022 (2 punkty), a jeśli ktoś ma wydanie drukowane – jest to arkusz 3, z tomu II.
W zadaniach 9.1. oraz 9.2. należało wykazać się znajomością procesów hydrolizy przebiegających w roztworach wodnych. Mamy tu do czynienia z hydrolizą kationową, kationowo-anionową oraz anionową. Wszystkie te zagadnienia omawiam nie tylko podczas lekcji związanej z solami, ale również w artykule, którego treść znajdziesz pod tym linkiem.
W zadaniu 10. należało policzyć stężenie roztworu chlorku manganu(II) powstałego po wprowadzeniu do innego roztworu tego związku chemicznego hydratu i całkowitym jego rozpuszczeniu. To zadanie można było rozwiązać na kilka sposobów, w tym również stosując regułę mieszania roztworów (przeliczając uprzednio stężenie molowe wyjściowego roztworu na procentowe), czasem zwyczajowo nazywaną „krzyżakiem”, o czym piszę w tym artykule. Osobiście wybrałem inną metodę w proponowanym przeze mnie modelu odpowiedzi, ale tutaj CKE tradycyjnie daje „wolną rękę” – ważne, aby zastosowana metoda była poprawna!
W kolejnym zadaniu trafiamy na bilans jonowo-elektronowy w środowisku zasadowym, przez wielu z Was znienawidzony, bo podobno trudniejszy… Trudność w zasadzie związana jest z dodatkowym krokiem w procedurze bilansowania, a jaki to krok? Omówienie znajdziecie między innymi w lekcji procesy redoks, część 1 – reakcje redoks, bilans jonowo-elektronowy, ale i w tym artykule. A co w przypadku, gdy brakuje nam drugiego równania połówkowego w treści zadania? No cóż – od czegoś mamy właśnie brudnopis, żeby je sobie zapisać…
Gdy przeszedłem do zadań nr 12.1 oraz 12.2, myślałem, że coś mi się przywidziało. Dlaczego? Popatrzcie, na jakim przykładzie omawiam pewne ogniwo chemiczne zbudowane z dwóch półogniw redoks w stanie standardowym (elektrochemia, część 1 – półogniwa i ogniwa chemiczne, korozja elektrochemiczna):


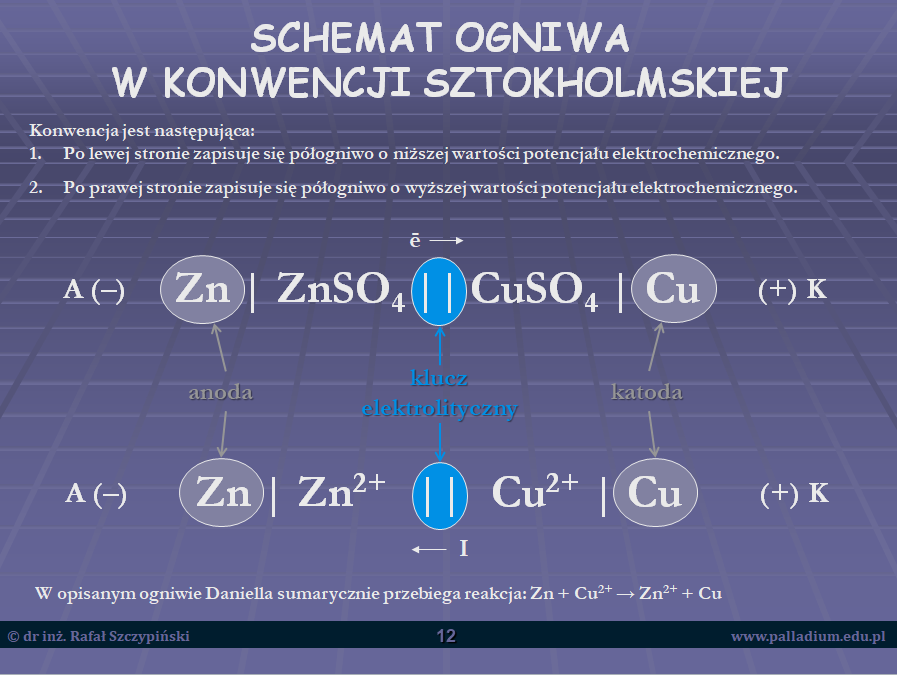
A na dobitkę konwencja sztokholmska, zgodnie z którą zapisujemy schemat ogniwa chemicznego, przy czym podczas lekcji omówiona została na przykładzie ogniwa Daniella. Znając schemat każdego z półogniw redoks, zapisanie ogniwa według w/w konwencji nie powinno stanowić problemu:
Zadanie 13. związane było z równowagą w układzie gazowym. 13.1. to klasyczne zadanie związane z regułą przekory, tutaj akurat z wpływem ciśnienia oraz temperatury na położenie stanu równowagi. Gdzieś już jednak widzieliśmy równanie tej przemiany chemicznej, ale zapisane dla reakcji odwrotnej. Zgadza się – mowa o lekcji termodynamika oraz statyka reakcji chemicznych, część 3 – równowagi chemiczne, reguła przekory:

A co do ciśnienia – nie ma tutaj ono wpływu na położenie stanu równowagi, ponieważ wynikająca ze stechiometrii reakcji sumaryczna liczb moli gazowych substratów równa jest sumarycznej liczbie moli gazowych produktów, co również wyjaśniam w tej samej lekcji, ale na przykładzie innej reakcji chemicznej… Zadanie 13.2. z kolei związane było z obliczeniami dotyczącymi opisanej w informacji wstępnej do zadania reakcji równowagowej. Najbardziej wygodnym sposobem rozwiązywania tego typu zadań jest zastosowanie tabeli bilansu materiałowego, która pojawia się praktycznie w każdym rozwiązaniu tego typu zadań…
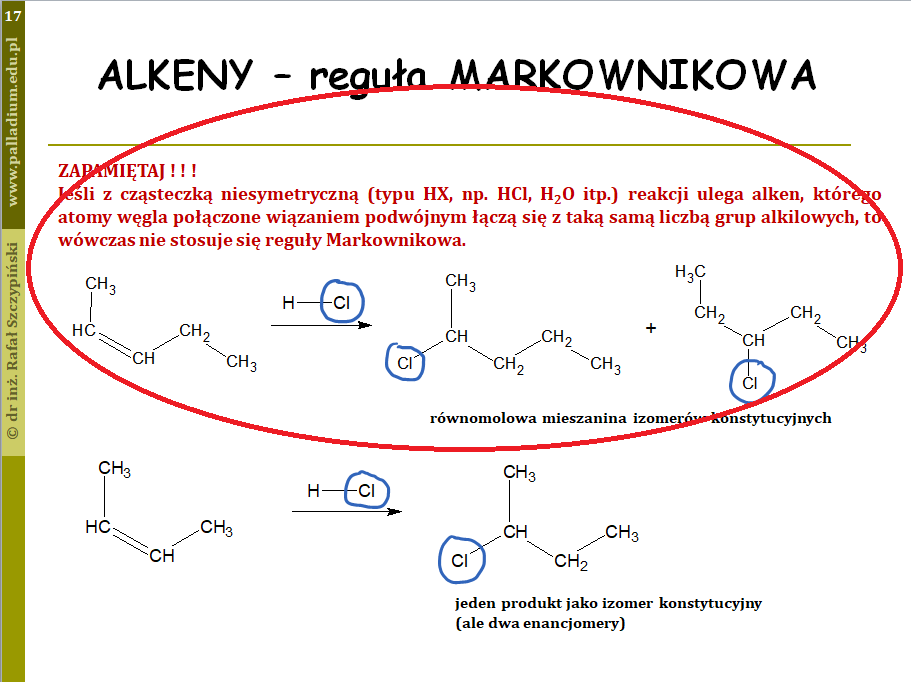
Od zadania 14. rozpoczyna się klasyczna chemia organiczna. Otwiera ją zadanie związane z addycją bromowodoru do pent-2-enu. W wyniku takiej przemiany powstaje mieszanina izomerów konstytucyjnych – tutaj jednak reguła Markownikowa nie ma zastosowania, a dlaczego? Porównajcie to zadanie z fragmentem lekcji węglowodory, część 2 – alkeny oraz alkiny, alifatyczne węglowodory nienasycone:
Eliminacja o której mowa w tej reakcji przebiega zgodnie z regułą Zajcewa, która również omówiona została przeze mnie podczas tej samej lekcji…
Zadanie 15., jest takim na dobitkę, aby sprawdzić znajomość reguły Markownikowa wśród maturzystów. Ponadto należało się również wykazać w tym zadaniu umiejętnością właściwego formułowania uzasadnienia do udzielonej odpowiedzi.
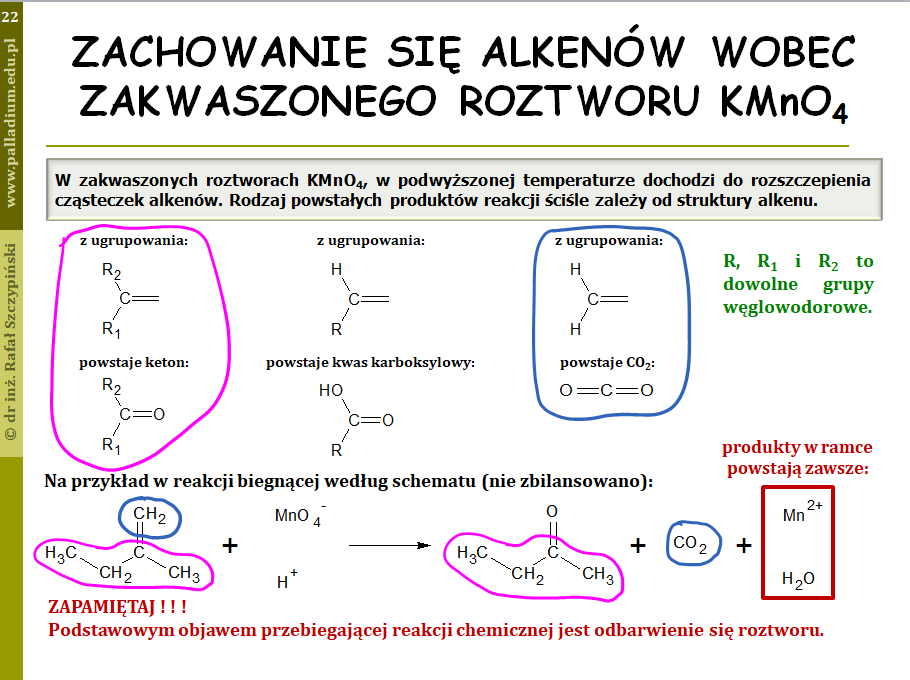
Zadania 16.1. oraz 16.2. związane były z reakcją rozszczepienia alkenu. Tego typu zagadnienie pojawiło się już na maturze kilka razy, dlatego postanowiłem omówić je szerzej we wspomnianej już lekcji związanej z alkenami – poświęciłem temu jeden slajd z prezentacji:
W zadaniu 16.2. sprawdzano dodatkowo, czy uczeń potrafi określić jak długość łańcucha węglowego wpływa na moc kwasu karboksylowego, albo czy zdający maturę potrafi odnaleźć w tablicach odpowiednie dane dotyczące stałych dysocjacji produktów rozszczepienia cząsteczki pent-2-enu. Następnie należało napisać wzór tej soli, która pochodzi od mocniejszego z powstałych kwasów karboksylowych.
Zadanie 17.1. to drugie zadanie z fotografiami odczynników. Związane było z reakcją redoks jaka przebiega między związkiem nienasyconym (styren) a wodnym roztworem manganianu(VII) potasu. CKE dopuszcza tutaj kilka możliwości odpowiedzi – jedną z nich jest „klasyczna”, o jakiej uczymy się w szkole – gdy powstaje diol. Jednak z uwagi na bezpośrednie sąsiedztwo pierścienia aromatycznego oraz wiązania C = C w łańcuchu bocznym, dochodzi tutaj również do rozszczepienia cząsteczki, co skutkuje utworzeniem kwasu benzoesowego. Jest to jednak wiedza wykraczająca poza zakres maturalny, co oznacza, że zadanie nie zostało do końca przemyślane przez osoby układające arkusz. Tak, czy inaczej uczeń musi wiedzieć, co jest produktem redukcji manganu z VII na IV stopień utlenienia oraz jaką barwę ma powstały związek tego pierwiastka chemicznego.
Zadanie 17.2. natomiast dotyczyło odróżniania dwóch pozostałych węglowodorów – cykloheksanu oraz benzenu z wykorzystaniem mieszaniny nitrującej. Reakcję taką omawiamy podczas lekcji związanej z węglowodorami aromatycznymi:

Widoczne na zamieszczonej w zadaniu fotografii żółte zabarwienie górnej warstwy potwierdza obecność benzenu (węglowodór aromatyczny), a nie cykloheksanu…
W zadaniu 18. należało uzupełnić schemat tak, aby przedstawiał równanie reakcji spalania fragmentu łańcucha PVC. Z opisu produktów spalania dowiadujemy się, że powstaje para wodna, tlenek węgla(IV) oraz bezbarwny gaz o ostrym zapachu. Tutaj pojawił się problem, bowiem przed zapisaniem równania reakcji chemicznej należało określić wzór ostatniej z wymienionych substancji. Chlor odpada, ponieważ ma żółtozieloną barwę, a zatem wybór musiał paść na związek chloru, a dokładniej chlorowodór (bezbarwny gaz o ostrym, drażniącym zapachu), któremu poświęcam krótką chwilę podczas lekcji chemia nieorganiczna, część 1 – wodór oraz wodorki pierwiastków bloków s i p.
Zadanie 19. dotyczyło wieloetapowego procesu chemicznego, prowadzącego do otrzymania PVC z wyjściowego substratu jakim był zanieczyszczony karbid. To zadanie z zakresu stechiometrii nie powinno sprawić problemów tym osobom, które sumiennie rozwiązały poniższe dwa zadania z platformy PALLADIUM:
Obliczanie ilości pierwiastka uzyskanego w wieloetapowym procesie reakcyjnym
Obliczanie niezbędnej ilości substratu użytego w wieloetapowym procesie
Powyższe dwa zadania znajdują się również w drukowanej wersji zbioru zadań (rozdział 1.2) i są to odpowiednio zadania nr 45 oraz 33.
Odpowiedź na zadanie 20.1. powinna nasunąć się natychmiast po przeczytaniu tekstu wstępnego, ponieważ o szybkości procesu wieloetapowego decyduje reakcja biegnąca w najwolniejszym etapie (lekcja termodynamika oraz statyka reakcji chemicznych, część 2 – kinetyka chemiczna):

W zadaniu 20.2. należało zapisać równanie sumaryczne procesu, a w zadaniu 20.3. pada pytanie o proces autokatalityczny. Odpowiedzi do tych zadań również można znaleźć w tej samej lekcji, choć omówione zostały na innych przykładach.
Zadanie 21.1. to niemal kopia części lekcji kwasy karboksylowe:
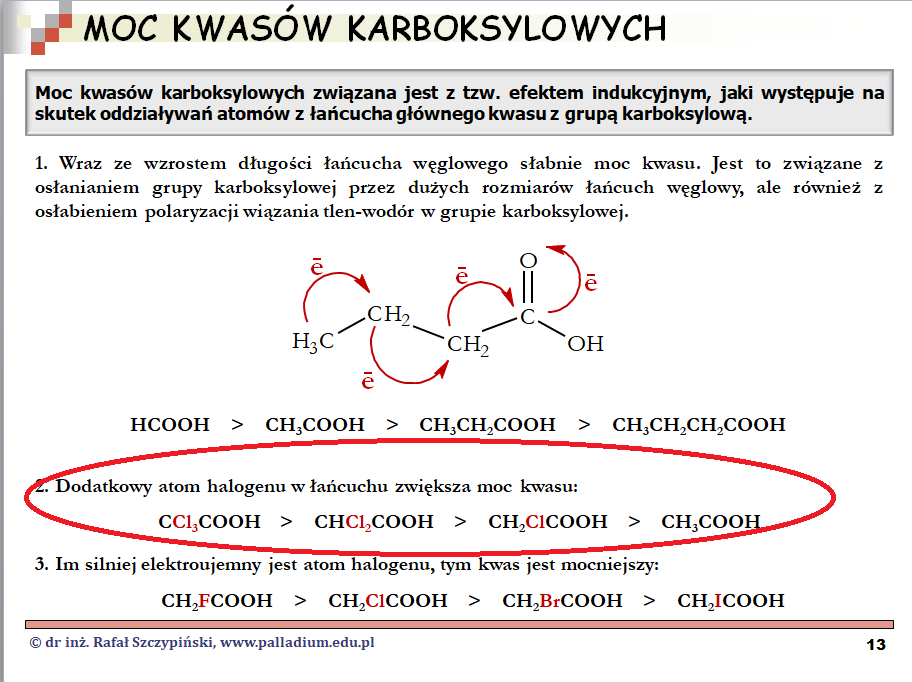
Wystarczyło tylko pamiętać, że przy tej samej wartości stężenia molowego roztworu, roztwór kwasu mocniejszego ma niższe pH. Z kolei w drugiej części zadania wystarczyło tylko wpisać poprawną wartość pKa wybranego kwasu. A jak to zrobić – wyjaśniam podczas lekcji chemia nieorganiczna, część 4 – kwasy:

Zadanie 22. polegało właściwie na uzupełnieniu schematu reakcji na podstawie jej opisu zawartego w informacji wstępnej do zadania, a w zadaniu 23. należało odpowiednio wyjaśnić dlaczego jedna z opisanych w informacji wstępnej reakcji przebiega z większą wydajnością. Również i w tym przypadku część odpowiedzi była ukryta w informacji wstępnej do zadania (zdanie numer 2 w pierwszym akapicie).
W zadaniu 24.1. należało napisać wzory grupowe odpowiednich związków chemicznych, które brały udział w reakcjach opisanych schematem ciągu przemian chemicznych. W takim przypadku zaczynamy od tej przemiany, na temat której mamy najwięcej informacji, a zatem zaczynamy od końca. Jeśli produktem jest ester, a my używamy kwasu jako substratu w środowisku kwasowym, to odszukujemy we wzorze estru fragment reszty alkoholu – związku chemicznego, który został użyty jako drugi substrat w estryfikacji. Alkohol ten powstał z kolei w wyniku reakcji podstawienia atomu bromu grupą -OH w środowisku wodnym. Skąd wiemy, że była to bromopochodna? Mamy podane w jakich warunkach przebiega reakcja 1… Zadanie 24.2. było już tylko formalnością dla tych osób, które wiedzą kiedy mamy do czynienia z reakcją substytucji oraz addycji, jak również potrafią przypisać takim reakcjom odpowiedni mechanizm ich przebiegu. Omawiam to w tutorialu jak rozpoznać typ oraz mechanizm reakcji chemicznej?
Cóż mogę powiedzieć na temat zadania 25.? Było to najwyżej punktowane zadanie – problemowe. Dokładnie jeden dzień przed maturą z chemii zamieściłem autorskie zadanie, w którym należało określić wzór elementarny związku chemicznego na podstawie danych ilościowych o produktach jego spalania. Kto uważnie prześledził film z rozwiązaniem tego zadania nie powinien mieć problemów z zadaniem maturalnym. W rozszyfrowaniu wzorów grupowych związków chemicznych z pewnością pomogła znajomość przebiegu próby Trommera, która omówiona została w ramach jednego z przeprowadzonych przeze mnie i nagranych doświadczeń chemicznych: Próba Trommera. Ponadto należało wykazać się znajomością pojęcia chiralności związku chemicznego (lekcja izomeria optyczna), która dotyczyła aldehydu glicerynowego oraz kwasu 2-hydroksypropanowego. Chiralność cząsteczek tych dwóch związków chemicznych poruszam we wspomnianej lekcji. W ostatniej części zadania należało zapisać poprawne równanie reakcji nieczynnego optycznie kwasu 3-hydroksyproanowego z wodorotlenkiem sodu. Tutaj pamiętamy, że reakcja biegnie z udziałem grupy karboksylowej, a nie hydroksylowej połączonej z atomem węgla należącym do łańcucha alifatycznego. Mamy tutaj pewną analogię do alkoholi monohydroksylowych, które przecież nie reagują z wodorotlenkiem sodu.
Zadanie 26. dotyczyło reakcji wypierania słabej zasady Brønsteda (2-metyloaniliny) z jej soli. W podanym schemacie należało wpisać wzory odpowiednich cząsteczek oraz jonów. Popatrzmy zatem na lekcję aminy i amidy:
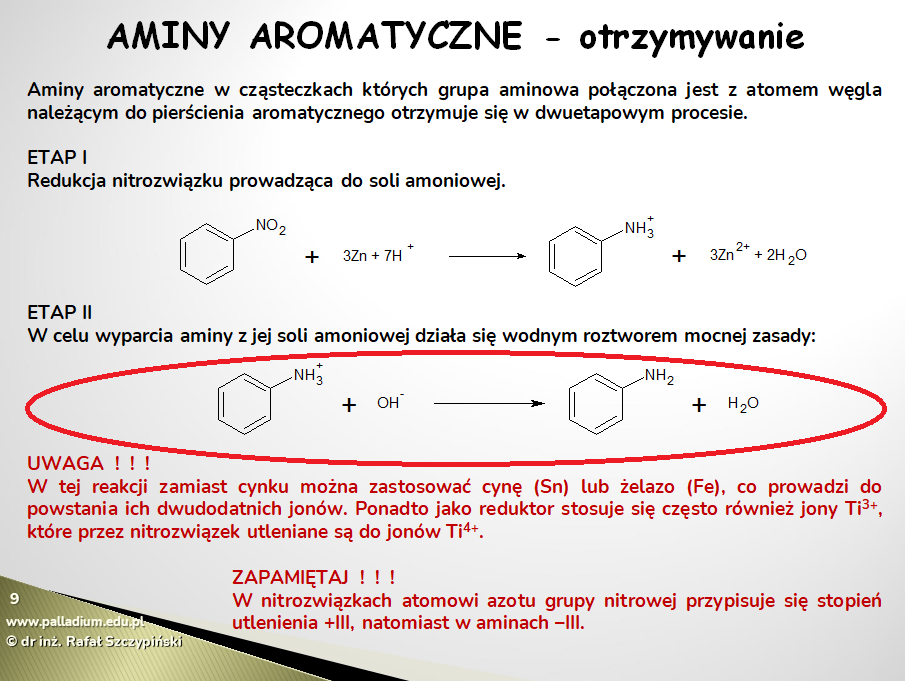
Jest oczywiście niewielka różnica – na maturze pojawiło się zadanie z najbliższym homologiem benzenu, jednak jeśli chodzi o samą reakcję chemiczną – ulegają jej wszystkie tego typu sole amoniowe. Ale co się również okazuje – podobny schemat reakcji widzimy w dziale z zadaniami związanymi z aminami platformy PALLADIUM oraz w wersji drukowanej zbioru zadań (rozdział 7.6, zadania 1.-5.). Ponadto dwa identyczne zadania rozwiązywaliśmy podczas sobotnich zajęć na żywo (pakiet biolchema) związanych z aminami oraz amidami.
Zadanie 27. jest zadaniem kontrowersyjnym. Należało zapisać wzór produktu bromowania w obecności światła (substytucja rodnikowa) 2-metyloaniliny. Jak słusznie zauważył Damian Mickiewicz z biomist.pl jest tu duża nieścisłość, ponieważ grupa aminowa aktywuje pierścień aromatyczny i zdecydowanie przebiegnie bromowanie pierścienia, niż grupy metylowej w cząsteczce tej aminy. Aczkolwiek na usprawiedliwienie autora zadania można podać, że maturzyści nie muszą wiedzieć, że grupa aminowa jest aktywatorem podstawienia elektrofilowego, stąd w produkcie bromowania rysujemy wzór 2-bromometyloaniliny. A co do odpowiedzi na temat reakcji redoks – wystarczy określić stopień utlenienia atomu węgla w grupie metylowej i w produkcie bromowania. Jak się to robi – omawiam podczas lekcji procesy redoks, część 1 – reakcje redoks, bilans jonowo-elektronowy, ale i w tym artykule „Przypisywanie wartości stopni utlenienia pierwiastkom w związkach organicznych„.
W zadaniu 28. mieliśmy do czynienia z różnymi formami aminokwasu – fenyloalaniny, jakie występują w środowisku o danej wartości stężenia kwasu, zasady oraz w pH odpowiadającym punktowi izoelektrycznemu. Należało narysować dominującą formę tego aminokwasu w każdym ze środowisk. Mamy tu jednak pewien zgrzyt, bowiem powinno to być każdorazowo środowisko buforowane, a nie roztwór kwasu czy zasady, z którymi nasz aminokwas wchodzi w reakcję chemiczną zmieniając tym samym wartość pH środowiska… No dobrze – wybaczamy, ponieważ nie wiemy, ile tak naprawdę tego aminokwasu wprowadzamy i określamy jaka postać fenyloalaniny powinna zostać narysowana. To tłumaczę na przykładzie glicyny podczas lekcji biocząsteczki, część 1 – aminokwasy, peptydy, białka:
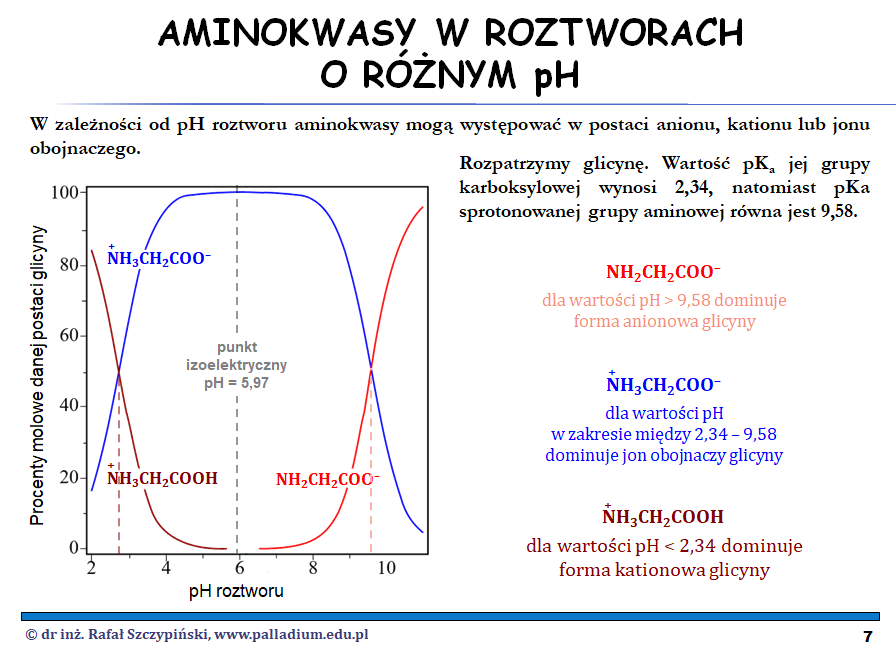
Zadanie 29. to swego rodzaju test na spostrzegawczość oraz umiejętność formułowania właściwej odpowiedzi. Swoją drogą wystarczyło powołać się na podobieństwo w budowie fragmentów cząsteczek D-glukozy oraz D-mannozy. Gdzieś już to było omówione – popatrzmy na lekcję biocząsteczki, część 2 – cukry, glikozydy:

W ten sposób dobrnęliśmy do ostatniego zadania z tegorocznego arkusza, zadania nr 30. Należało wybrać taki cukier, którego produkt degradacji Ruffa po utlenieniu daje kwas mezo-winowy. Wzór tego kwasu z omówieniem pojawia się we wspomnianej już lekcji dotyczącej izomerii optycznej. Co do reakcji utleniania cukrów kwasem azotowym(V) – popatrzmy tutaj:

Co mogę powiedzieć?
Wszystkim, którzy sumiennie pracowali z platformą PALLADIUM już mogę pogratulować wysokich wyników z tegorocznej matury! Tymczasem przyszłorocznych maturzystów zapraszam na organizowany wspólnie z dwmed.pl kolejny już kurs przygotowujący do matury z chemii oraz biologii. Szczegóły znajdziecie pod tym linkiem.
Spodobał Ci się ten artykuł? Polub mój fanpage na Facebooku oraz na Instagramie, aby nie ominęły Cię żadne nowości.
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone