17.01.2021 | 0 komentarze

Wiązania wodorowe są najsilniejszymi spośród dotychczas poznanych oddziaływań międzycząsteczkowych. Aby takie oddziaływanie mogło powstać powinny być spełnione trzy poniższe warunki.
1. Obecność atomu silnie elektroujemnego pierwiastka chemicznego (azot, tlen, fluor) w każdej z cząsteczek.
2. W pierwszej z cząsteczek pierwiastek ten (azot, tlen, fluor) musi być połączony wiązaniem kowalencyjnym spolaryzowanym z atomem wodoru (cząsteczka będzie wówczas donorem wiązania wodorowego).
3. W drugiej z cząsteczek pierwiastek ten (azot, tlen, fluor) musi mieć co najmniej jedną wolną parę elektronową (cząsteczka będzie wówczas akceptorem wiązania wodorowego).
Opisane oddziaływanie tworzy się, gdy atom wodoru położony jest pomiędzy dwoma silnie elektroujemnymi atomami (któregoś z wyżej wymienionych trzech pierwiastków chemicznych), zawierającego wolne pary elektronowe pierwiastka. Najbardziej typowym przykładem związku chemicznego, między cząsteczkami którego tworzą się wiązania wodorowe jest woda. Każde wiązanie H–O w jej cząsteczkach jest silnie spolaryzowane w kierunku silnie elektroujemnego atomu tlenu, co oznacza, że na atomie tym zlokalizowany jest cząstkowy ładunek ujemny (δ–), a na atomie wodoru cząstkowy ładunek dodatni (δ+) (więcej o polaryzacji wiązań przeczytasz w tym artykule). Gdy dwie cząsteczki wody zbliżą się do siebie, wówczas atom wodoru z cząstkowym ładunkiem dodatnim pierwszej z nich przyciągany jest przez wolną parę elektronową tlenu z drugiej cząsteczki wody. W efekcie przyciągania wolnej pary elektronowej i cząstkowego ładunku dodatniego tworzy się wiązanie, które na schematycznych rysunkach umownie przedstawia się linią przerywaną:
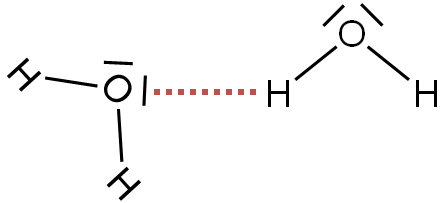
W wodzie ciekłej, z uwagi na stosunkowo dużą ruchliwość cząsteczek, nieustannie dochodzi do zrywania się i tworzenia kolejnych wiązań wodorowych. W przypadku lodu (woda w stałym stanie skupienia) ruchliwość cząsteczek jest ograniczona, a cała struktura stabilizowana jest przez tworzenie się między nimi wiązań wodorowych. Dzięki temu cząsteczki wody utrzymywane są w pewnej (w miarę stałej) odległości od siebie.
Co z tym śniegiem?
Do utworzenia się płatka śniegu potrzebna jest mikroskopijnych rozmiarów cząstka stała – na przykład drobinka kurzu, bądź innego zanieczyszczenia. To na jej powierzchni będzie odbywać się wzrost kryształka lodu, jakim jest płatek śniegu. W sprzyjających warunkach ciśnienia i temperatury dochodzi wtedy do resublimacji wody, czyli zmiany jej stanu skupienia z gazowego w stały, co odbywa się po zetknięciu jej cząsteczek ze wspomnianą powierzchnią kurzu. Proces taki przebiega dość szybko, a jednocześnie na tyle wolno, że cząsteczki wody „mają czas” na regularne ułożenie się w przestrzeni w postać sześciokątnych układów, co ilustruje poniższy schemat:
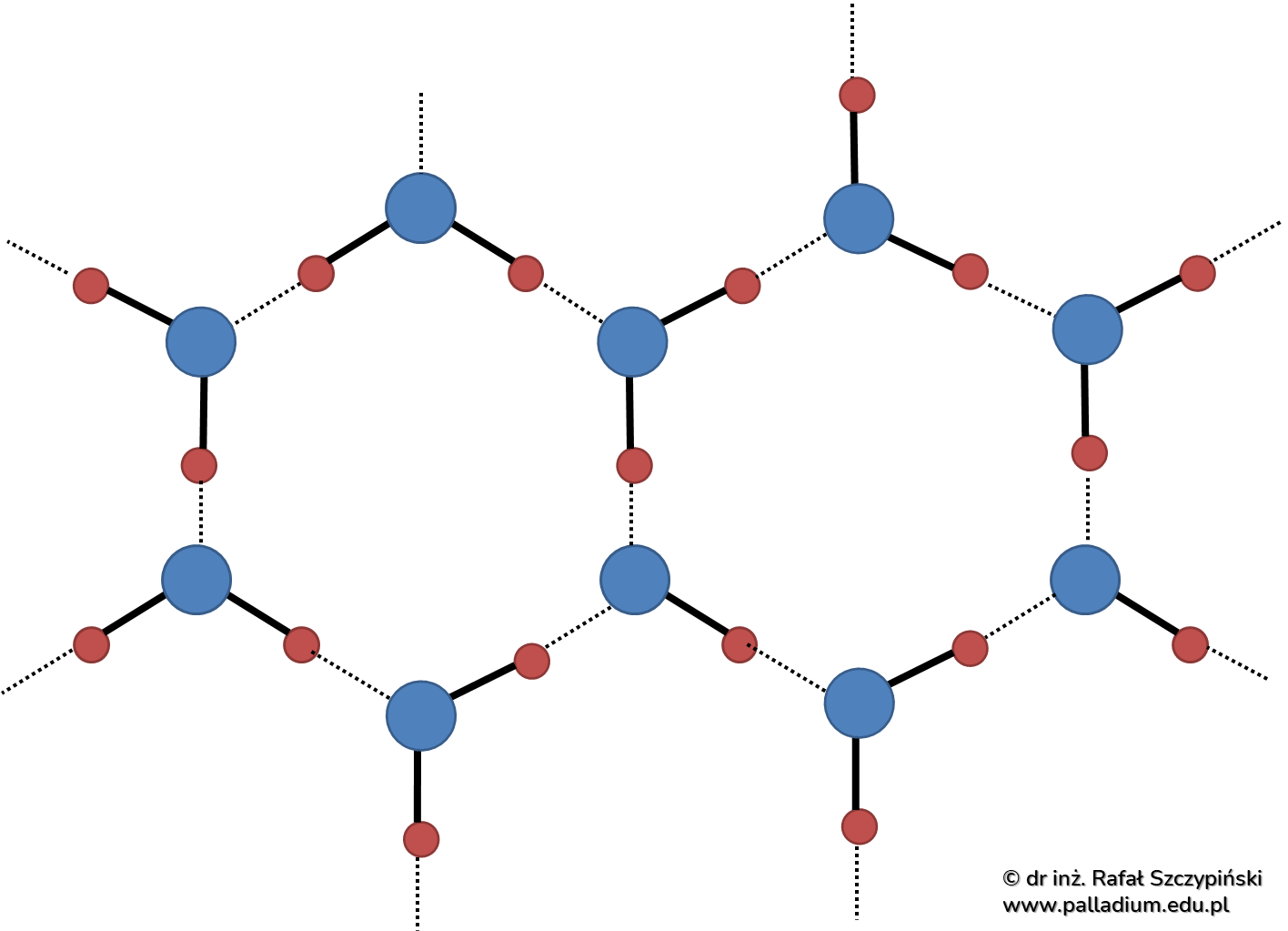
To właśnie takie układy są najbardziej trwałe dla płatków śniegu. Opisane zbiory sześciokątów mogą przyłączać kolejne cząsteczki wody, rozrastając się do stosunkowo dużych kryształów. Mnie udało się sfotografować płatki śniegu o wielkości około 3–7 milimetrów, co możesz sobaczyć na kilku poniższych zdjęciach.

Chcesz wiedzieć więcej na temat oddziaływań międzycząsteczkowych? Zapraszam do obejrzenia tej lekcji.
Spodobał Ci się ten artykuł? Polub mój fanpage na Facebooku oraz na Instagramie, aby nie ominęły Cię żadne nowości.
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone