29.01.2021 | 0 komentarze

Prawo rozcieńczeń Ostwalda jest dogodnym narzędziem służącym do obliczeń stopnia dysocjacji słabego elektrolitu. Ilustruje je wyrażenie:
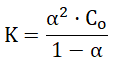
w którym:
K – stała dysocjacji elektrolitu,
α – stopień dysocjacji elektrolitu,
Co – stężenie molowe roztworu elektrolitu.
W przypadku, gdy wartość stopnia dysocjacji jest mniejsza niż 5% lub obliczona wartość stosunku wartości stężenia elektrolitu (Co) do wartości stałej dysocjacji (K) jest większa, bądź równa 400, wówczas można zastosować wzór uproszczony:
![]()
Dzięki temu, w celu obliczenia stopnia dysocjacji – a dalej na przykład – określenia liczb jonów powstałych w wyniku dysocjacji unika się rozwiązywania o wiele bardziej skomplikowanej postaci równania kwadratowego. Zmniejszamy wtedy szansę na pomyłkę podczas wykonywania obliczeń. Zdarza się jednak dość często, że uproszczona forma wzoru prawa rozcieńczeń Ostwalda nie może zostać zastosowana.
Rozważmy następujące zadanie.
W temperaturze 25 oC przygotowano wodne roztwory kilku związków chemicznych:
HF o stężeniu 0,2 mol·dm–3
HClO2 o stężeniu 1 mol·dm–3
CH3COOH o stężeniu 0,05 mol·dm–3
(CH3)3N o stężeniu 0,08 mol·dm–3
HCOOH o stężeniu 3 mol·dm–3
C6H5COOH o stężeniu 0,001 mol·dm–3.
Uszereguj podane w informacji wstępnej roztwory według wzrastającego stopnia dysocjacji znajdujących się w nich związków chemicznych.
Do obliczenia stopnia dysocjacji kwasu metanowego, octowego oraz trimetyloaminy możemy zastosować wzór uproszczony, ponieważ wyrażenie Co:K w tych trzech przypadkach ma wartość większą niż 400. Zdecydowanie większe problemy obliczeniowe napotkamy w przypadku roztworów pozostałych trzech związków chemicznych (HF, HClO2 oraz C6H5COOH), ponieważ tym razem konieczne będzie rozwiązanie równania kwadratowego w postaci:
Co·α2 + K·α – K = 0
którą uzyskujemy w wyniku przekształcenia wzoru przedstawiającego prawo rozcieńczeń Ostwalda. Wykonując mozolne i dość długie obliczenia (w końcu Excel na egzaminie maturalnym nie będzie pod ręką) dochodzimy do następujących wyników wartości stopni dysocjacji:
HF = 5,46%
HClO2 = 9,95%
CH3COOH = 1,88%
(CH3)3N = 3%
HCOOH = 0,77%
C6H5COOH = 22,45%
W ten sposób straciliśmy co najmniej kilkanaście minut naszego życia. A gdyby tak można było wykonać to prościej i zajęłoby nam nie więcej niż 2-3 minuty? Niemożliwe? A jednak – jest to wykonalne, wystarczy znać pewną interesującą zależność…
Otóż graniczne wartości 5% (w przypadku stopnia dysocjacji) oraz 400 (Co:K) nie są przypadkowe. Jeśli przyjrzeć się dokładniej, to okazuje się, że wartości stopnia dysocjacji równej 5% odpowiada wartość wyrażenia Co:K równa dokładnie 400. Co z tego wynika? Popatrzmy na wartości wyrażeń Co:K naszych roztworów:
HF = 317
HClO2 = 91
CH3COOH = 2778
(CH3)3N = 1081
HCOOH = 16667
C6H5COOH = 15
oraz wyniki naniesione na wykres obrazujący zależność między stopniem dysocjacji a wartością wyrażenia Co:K każdego z wymienionych w zadaniu roztworów:
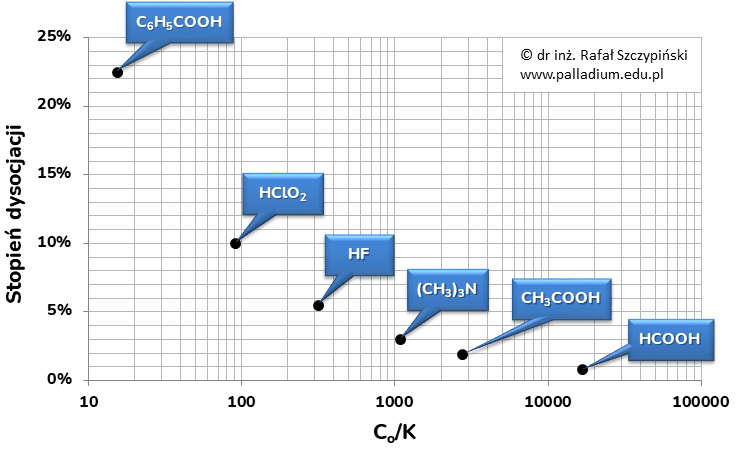
Z wykresu tego wynika, że: wraz ze wzrostem wartości wyrażenia Co:K maleje wartość stopnia dysocjacji.
Reasumując, jeśli w danej temperaturze znamy wartość stałej dysocjacji słabych elektrolitów oraz stężenia molowe ich wodnych roztworów, nie musimy obliczać wartości stopnia dysocjacji, aby uszeregować je według zmiany tej wielkości. Wystarczy wówczas policzyć wartość wyrażenia Co:K dla każdego z nich.Odpowiadając na postawione w zadaniu polecenie, podane roztwory kwasów powinny zostać uszeregowane w następującej kolejności:
HCOOH, CH3COOH, (CH3)3N, HF, HClO2, C6H5COOH.
Omówienie prawa rozcieńczeń Ostwalda znajdziesz tutaj, a związane z tym zagadnieniem zadania są w tym miejscu.
Spodobał Ci się ten artykuł? Polub mój fanpage na Facebooku oraz na Instagramie, aby nie ominęły Cię żadne nowości.
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone