Ocena z uzasadnieniem, czy octanowinian glinu wykazuje czynność optyczną
W skład leku przeciwobrzękowego Altacet® wchodzą między innymi dwa związki chemiczne – octanowinian glinu oraz mentol. Wzory chemiczne opisanych substancji ilustrują rysunki:
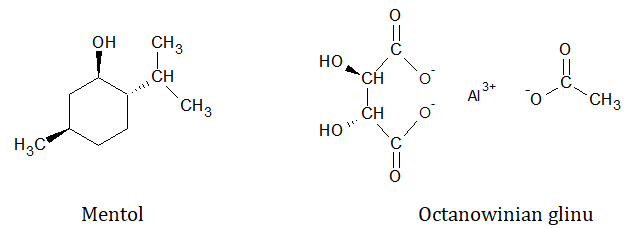
Mentol wykazuje działanie znieczulające, natomiast octanowinian glinu zmniejsza obrzęk przez denaturację białek w obrębie zapalnych zmian skóry.
Na podstawie: ulotka leku Altacet®, Sandoz Polska Sp. z o.o.
Oceń, czy octanowinian glinu, którego strukturę przedstawiono w informacji wprowadzającej wykazuje czynność optyczną. Uzasadnij odpowiedź. Ocena: Uzasadnienie: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Rysowanie wzoru stanowiącego enancjomer cząsteczki mentolu
W skład leku przeciwobrzękowego Altacet® wchodzą między innymi dwa związki chemiczne – octanowinian glinu oraz mentol. Wzory chemiczne opisanych substancji ilustrują rysunki:

Mentol wykazuje działanie znieczulające, natomiast octanowinian glinu zmniejsza obrzęk przez denaturację białek w obrębie zapalnych zmian skóry.
Na podstawie: ulotka leku Altacet®, Sandoz Polska Sp. z o.o.
Narysuj wzór cząsteczki będącej enancjomerem mentolu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Dlaczego wody nie uwzględnia się w wyrażeniu na stałą dysocjacji kwasu?
Zauważyłem, że w zadaniach ze stałą dysocjacji kwasu nie uwzględnia się wody. Dlaczego?
Tutorial: jak zmieniła się masa blaszki?
Na filmie omówiono jak można określić, czy masa blaszki zmieniła się oraz czy był to wzrost, czy spadek jej masy.
Przypisywanie określeń do właściwości chemicznych oraz fizycznych. Podręcznik 1.3 zad. 1
Każdej substancji chemicznej można przypisać określone właściwości fizyczne oraz chemiczne.
Przyporządkuj podane określenia do właściwości chemicznych oraz fizycznych. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
a) Gęstość substancji.
b) Odczyn kwasowy wodnego roztworu.
c) Stały stan skupienia.
d) Temperatura topnienia równa 0 oC.
e) Silny utleniacz.
f) Barwa ceglastoczerwona.
g) Wysoka lotność.
h) Łatwopalność.
Wybór ucznia, który dokonał właściwych obserwacji oraz sformułował poprawne wnioski. Podręcznik 1.3 zad. 3
Przeprowadzono doświadczenie chemiczne, podczas którego przebiegła reakcja opisana równaniem:
2KMnO4(s) → K2MnO4(s) + MnO2(s) + O2(g)
Trzej uczniowie w swoich zeszytach zanotowali następujące opisy obserwacji:
Uczeń A: wydzielił się bezbarwny gaz, którym jest tlen.
Uczeń B: wydzielił się bezbarwny, bezwonny gaz, a barwa fazy stałej uległa zmianie.
Uczeń C: manganian(VII) potasu uległ rozkładowi, ponieważ jest substancją nietrwałą w odpowiednio wysokiej temperaturze.
Tylko jeden z uczniów w sposób poprawny zanotował obserwacje zjawisk towarzyszących przebiegowi tego doświadczenia. Wskaż, który był to uczeń oraz podaj, jakie błędy popełnili pozostali? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Tutorial: które atomy węgla oraz wodoru są równocenne?
W filmie omówione zostało zagadnienie równocenności atomów węgla oraz wodoru i związane z tym liczby możliwych do uzyskania monochloropochodnych.
Tutorial: rysowanie wzorów grupowych izomerów szkieletowych alkanów
W filmie omówiono sposób rysowania wzorów grupowych izomerów szkieletowych alkanów na przykładzie n-heptanu. Metoda ta znacząco przyspieszy rysowanie przez Ciebie wzorów oraz minimalizuje możliwość pominięcia któregokolwiek z izomerów szkieletowych.
Obliczanie szybkości reakcji chemicznej biegnącej w niższej temperaturze, reguła van't Hoffa. Podręcznik 2.2 zad. 1
Zależność szybkości reakcji chemicznej od temperatury z pewnym przybliżeniem opisuje tzw. reguła van’t Hoffa, którą przedstawia się wzorem:
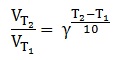
W wyrażeniu tym VT1 oraz VT2 to szybkości reakcji prowadzonych w temperaturach – bazowej (T1) oraz po jej zmianie (T2) – zwiększeniu, bądź zmniejszeniu. Parametr γ to tzw. współczynnik temperaturowy van’t Hoffa, który jest wielkością charakterystyczną dla danej reakcji chemicznej.
Współczynnik temperaturowy van’t Hoffa pewnej biegnącej zgodnie z kinetyką I-rzędu reakcji chemicznej ma wartość równą 2. Przy stężeniu substratu równym 1 mol∙dm–3 początkowa szybkość tej reakcji w temperaturze T1 wynosi 0,15 mol·dm–3·s–1.
Oblicz, jaka byłaby szybkość początkowa tej reakcji, gdyby przeprowadzono ją w temperaturze T2 niższej o 20 K od temperatury podanej w informacji wprowadzającej? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Brak zmiany szybkości reakcji chemicznej pomimo obniżenia temperatury, reguła van't Hoffa. Podręcznik 2.2 zad. 2
Zależność szybkości reakcji chemicznej od temperatury z pewnym przybliżeniem opisuje tzw. reguła van’t Hoffa, którą przedstawia się wzorem:
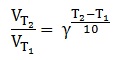
W wyrażeniu tym VT1 oraz VT2 to szybkości reakcji prowadzonych w temperaturach – bazowej (T1) oraz po jej zmianie (T2) – zwiększeniu, bądź zmniejszeniu. Parametr γ to tzw. współczynnik temperaturowy van’t Hoffa, który jest wielkością charakterystyczną dla danej reakcji chemicznej.
Współczynnik temperaturowy van’t Hoffa pewnej biegnącej zgodnie z kinetyką I-rzędu reakcji chemicznej ma wartość równą 2. Przy stężeniu substratu równym 1 mol∙dm–3 początkowa szybkość tej reakcji w temperaturze T1 wynosi 0,15 mol·dm–3·s–1.
Zaproponuj, co należałoby zrobić, aby po obniżeniu temperatury początkowej układu o 20 K, reakcja przebiegła z taką samą szybkością, jak w temperaturze T1, jeśli nie mamy możliwości zastosowania katalizatora? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ocena, czy wykonanie określonej czynności wpłynie na ilość zanieczyszczeń w mieszaninie poreakcyjnej. Podręcznik 2.2 zad. 3
Produktem reakcji termicznego rozkładu chloranu(V) potasu są dwa związki chemiczne – chloran(VII) potasu oraz chlorek potasu. Jeśli proces ten przeprowadzi się w obecności katalizatora – tlenku manganu(IV), produktami reakcji będą głównie chlorek potasu i tlen. Do 4,96 g chloranu(V) potasu dodano niewielką ilość katalizatora manganowego (MnO2), przy czym nie został on rozprowadzony w próbce w sposób równomierny. Zawartość naczynia prażono do momentu ustalenia się stałej masy.
Oceń, czy równomierne rozproszenie katalizatora w próbce spowoduje wzrost, czy może spadek ilości zanieczyszczeń w postaci chloranu(VII) potasu w mieszaninie poreakcyjnej? Uzasadnij swoje stanowisko. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone

