Określanie wpływu wybranych czynników na położenie stanu równowagi reakcji chemicznej (reguła przekory). Podręcznik 2.2 zad. 4
Przebiegającą w fazie gazowej pirolizę metanu opisuje równanie stechiometryczne:
2CH4 ⇄ C2H2 + 3H2 ΔHo = 381 kJ
W jaki sposób przesuwając stan równowagi tej reakcji chemicznej można zwiększyć ilość acetylenu w układzie poprzez zmianę: a) ciśnienia, b) temperatury, c) pojemności naczynia reakcyjnego. Uzasadnij swoje stanowisko. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór probówki, w której reakcja przebiegła z większą szybkością. Podręcznik 2.2 zad. 5
Przygotowano cztery układy reakcyjne, które przedstawia rysunek poniżej:
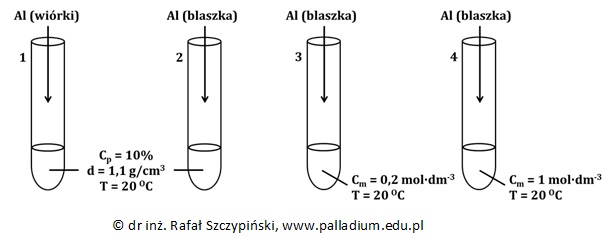
Przed rozpoczęciem doświadczenia, w każdej z probówek znajdowały się wodne roztwory wodorotlenku sodu o takiej samej objętości, równej 5 cm3. Do każdej z probówek wprowadzono próbkę glinu o takiej samej masie, ale w różnej postaci (blaszka lub wiórki).
W której z probówek reakcja przebiegła z większą szybkością? W wykropkowane pola wstaw odpowiedni znak „<” lub „>”. 1 ……………… 2 2 ……………… 3 © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ocena możliwości szybszego lub wolniejszego przebiegu reakcji chemicznej wraz z uzasadnieniem. Podręcznik 2.2 zad. 6
Przygotowano cztery układy reakcyjne, które przedstawia rysunek poniżej:

Przed rozpoczęciem doświadczenia, w każdej z probówek znajdowały się wodne roztwory wodorotlenku sodu o takiej samej objętości, równej 5 cm3. Do każdej z probówek wprowadzono próbkę glinu o takiej samej masie, ale w różnej postaci (blaszka lub wiórki).
Reakcja glinu z wodnym roztworem wodorotlenku sodu jest procesem egzotermicznym.
Oceń, czy po wprowadzeniu aluminiowej blaszki reakcja ta biegłaby szybciej, czy wolniej w probówce nr 4, gdyby początkowa temperatura roztworu (przed wprowadzeniem glinu) wynosiła 60 ⁰C? Uzasadnij swoją odpowiedź. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Tutorial: mechanizm reakcji substytucji elektrofilowej na przykładzie chlorowania benzenu
Na filmie omówiony został mechanizm reakcji substytucji elektrofilowej z udziałem benzenu oraz chloru w obecności katalizatora w postaci chlorku żelaza(III).
Tutorial: jak rozpoznać typ oraz mechanizm reakcji chemicznej?
W filmie przedstawiono przykłady typów reakcji w chemii organicznej oraz ich mechanizmów, jakie obowiązują Cię do matury z chemii.
Ten tutorial dostępny jest nieodpłatnie pod poniższym linkiem:
Rozdział mieszaniny chlorku wapnia z siarką. Podręcznik 3.2 zad. 1
Dysponujesz wodą destylowaną oraz niezbędnym szkłem i aparaturą laboratoryjną.
Zaproponuj metodę rozdziału mieszaniny stanowiącej chlorek wapnia oraz siarkę. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Rozdział mieszaniny substancji ciekłych na składniki. Podręcznik 3.2 zad. 2
W kolbie okrągłodennej znajdowały się zlewki trzech substancji chemicznych: dichlorometanu (Twrz = 40 ⁰C), ortoksylenu (Twrz = 144 ⁰C) oraz heksanu (Twrz = 69 ⁰C).
Dysponując niezbędnym szkłem oraz aparaturą laboratoryjną zaproponuj doświadczenie, którego celem będzie rozdział podanej mieszaniny na poszczególne składniki. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór poprawnej kolejności użytych płuczek do gazów podczas oczyszczania metanu. Podręcznik 3.2 zad. 3
Metan zanieczyszczony siarkowodorem oraz domieszkami amoniaku oczyszcza się poprzez przepuszczenie opisanej mieszaniny gazów przez zestaw dwóch płuczek, przy czym dany rodzaj zanieczyszczenia usuwany zostaje tylko w jednej płuczce.
Spośród wodnych roztworów podanych związków chemicznych wybierz dwa, które posłużyłyby do usunięcia z opisanej mieszaniny gazów – najpierw amoniaku, a następnie siarkowodoru. Odczynniki: KOH(aq), NaCl(aq), H2SO4(aq). © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wyodrębnianie miedzi z mieszaniny zawierającej ten metal oraz cynk. Podręcznik 3.2 zad. 4
W zlewce znajdowały się wiórki miedziane zanieczyszczone nalotem cynkowym.
Dysponując niezbędną aparaturą oraz szkłem laboratoryjnym zaprojektuj doświadczenie, którego celem będzie uzyskanie możliwie czystej miedzi. Wybierz jeden spośród podanych odczynników HNO3(stęż), MnCl2(aq), HCl(aq): oraz opisz swój tok postępowania. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór odczynnika strącającego jony chlorkowe. Podręcznik 4.3 zad. 1
Analiza próbki wody przemysłowej o objętości 10 cm3 wykazała, że zawiera jony Fe2+, Mg2+, Ca2+ oraz aniony chlorkowe. Stężenia wszystkich kationów są jednakowe i wynoszą 0,002 mol∙dm–3.
Spośród wymienionych poniżej wodnych roztworów substancji, wybierz ten odczynnik, za pomocą którego z roztworu usunięte zostaną wyłącznie jony chlorkowe. Odpowiedź uzasadnij równaniem reakcji chemicznej, zapisanym w formie jonowej skróconej. Dostępne odczynniki w postaci roztworów wodnych: NaOH, ZnSO4, AgNO3, K3PO4. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Sporządzanie określonej masy nasyconego roztworu azotanu(V) srebra. Podręcznik 4.3 zad. 2
W temperaturze 293 K rozpuszczalność azotanu(V) srebra wynosi 210 g/100 g wody.
Wykonaj stosowne obliczenia, a następnie opisz niezbędne czynności, w celu przygotowania 50 g nasyconego w temperaturze 293 K wodnego roztworu azotanu(V) srebra. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie przybliżonej rozpuszczalności siarczanu(VI) potasu na podstawie reakcji strąceniowej. Podręcznik 4.3 zad. 3
Wyrażoną w g/100 g wody rozpuszczalność substancji można wyznaczyć pośrednio podczas pewnego doświadczenia chemicznego. Prowadzi się wówczas reakcję chemiczną, uzyskując osad praktycznie nierozpuszczalnego w wodzie związku chemicznego.
Do 50 g nasyconego w temperaturze 293 K roztworu K2SO4 wprowadzono taką ilość roztworu chlorku baru, że zawarta w nim substancja rozpuszczona była w nadmiarze, w stosunku do siarczanu(VI) potasu. Uzyskany osad przesączono, przemyto i wysuszono, a jego masa była równa 6,635 g.
Oblicz wyrażoną w g/100 g wody rozpuszczalność siarczanu(VI) potasu w temperaturze 293 K. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Sporządzanie roztworu kwasu siarkowego(VI) o określonym stężeniu procentowym metodą rozcieńczania stężonego roztworu kwasu. Podręcznik 4.3 zad. 4
Dysponujemy stężonym (96%) roztworem tego kwasu o gęstości 1,84 g·cm–3, wodą destylowaną oraz niezbędnym szkłem laboratoryjnym.
Wykonaj stosowne obliczenia, a następnie opisz niezbędne czynności, w celu przygotowania 230 g roztworu kwasu siarkowego(VI) o stężeniu 30%. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone

