Określanie symbolu pierwiastka chemicznego na podstawie opisu rozmieszczenia jego elektronów. Zadanie 1.1. Arkusz CKE chemia maj 2020 rozszerzony (2 punkty)
O dwóch pierwiastkach umownie oznaczonych literami X i Z wiadomo, że:
● oba przyjmują w związkach chemicznych taki sam maksymalny stopień utlenienia,
● konfiguracja elektronowa atomu pierwiastka X w stanie wzbudzonym, który powstał w wyniku przeniesienia jednego z elektronów sparowanych na podpowłokę wyższą energetycznie i nieobsadzoną, może zostać przedstawiona w postaci zapisu:
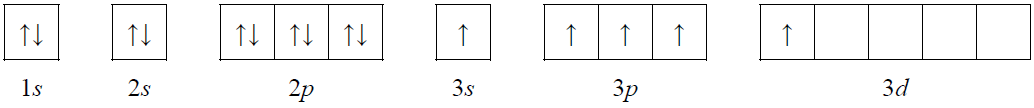
● w stanie podstawowym atom pierwiastka Z ma łącznie na ostatniej powłoce i na podpowłoce 3d pięć elektronów.
Wpisz do tabeli symbol pierwiastka X i symbol pierwiastka Z, numer grupy oraz symbol bloku konfiguracyjnego, do których należy każdy z pierwiastków.
Zapis wzoru wodorku oraz wartości maksymalnego stopnia utlenienia pierwiastków. Zadanie 1.2. Arkusz CKE chemia maj 2020 rozszerzony (1 punkt)
O dwóch pierwiastkach umownie oznaczonych literami X i Z wiadomo, że:
● oba przyjmują w związkach chemicznych taki sam maksymalny stopień utlenienia,
● konfiguracja elektronowa atomu pierwiastka X w stanie wzbudzonym, który powstał w wyniku przeniesienia jednego z elektronów sparowanych na podpowłokę wyższą energetycznie i nieobsadzoną, może zostać przedstawiona w postaci zapisu:
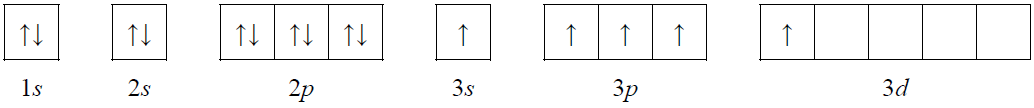
● w stanie podstawowym atom pierwiastka Z ma łącznie na ostatniej powłoce i na podpowłoce 3d pięć elektronów.
Napisz wzór sumaryczny wodorku pierwiastka X oraz maksymalny stopień utlenienia, jaki przyjmują pierwiastki X i Z w związkach chemicznych.
Wzór sumaryczny wodorku pierwiastka X:
Maksymalny stopień utlenienia, jaki przyjmują pierwiastki X i Z w związkach chemicznych:
Zapis pełnej konfiguracji elektronowej kationu z użyciem symboli podpowłok. Zadanie 1.3. Arkusz CKE chemia maj 2020 rozszerzony (1 punkt)
O dwóch pierwiastkach umownie oznaczonych literami X i Z wiadomo, że:
● oba przyjmują w związkach chemicznych taki sam maksymalny stopień utlenienia,
● konfiguracja elektronowa atomu pierwiastka X w stanie wzbudzonym, który powstał w wyniku przeniesienia jednego z elektronów sparowanych na podpowłokę wyższą energetycznie i nieobsadzoną, może zostać przedstawiona w postaci zapisu:
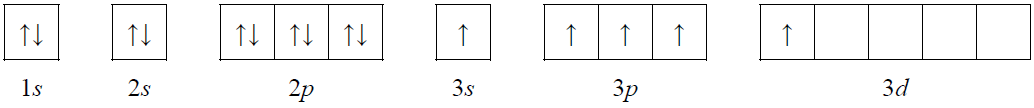
● w stanie podstawowym atom pierwiastka Z ma łącznie na ostatniej powłoce i na podpowłoce 3d pięć elektronów.
Przedstaw pełną konfigurację elektronową jonu Z2+ w stanie podstawowym. Zastosuj zapis z uwzględnieniem podpowłok.
Przypisywanie temperatury wrzenia do substancji. Zadanie 2. Arkusz CKE chemia maj 2020 rozszerzony (1 punkt)
Wpisz do tabeli temperaturę wrzenia wymienionych substancji (H2, CaCl2, HCl) pod ciśnieniem atmosferycznym. Wartości temperatury wrzenia wybierz spośród następujących: –253 oC, –85 oC, 100 oC, 1935 oC.
Wybór poprawnego wykresu dla zależności promienia atomowego oraz elektroujemności od liczby atomowej. Zadanie 3. Arkusz CKE chemia maj 2020 rozszerzony (1 punkt)
Poniżej przedstawiono cztery wykresy ilustrujące zmianę wybranych wielkości fizycznych charakteryzujących pierwiastki chemiczne (z wyłączeniem gazów szlachetnych) w funkcji ich liczby atomowej.
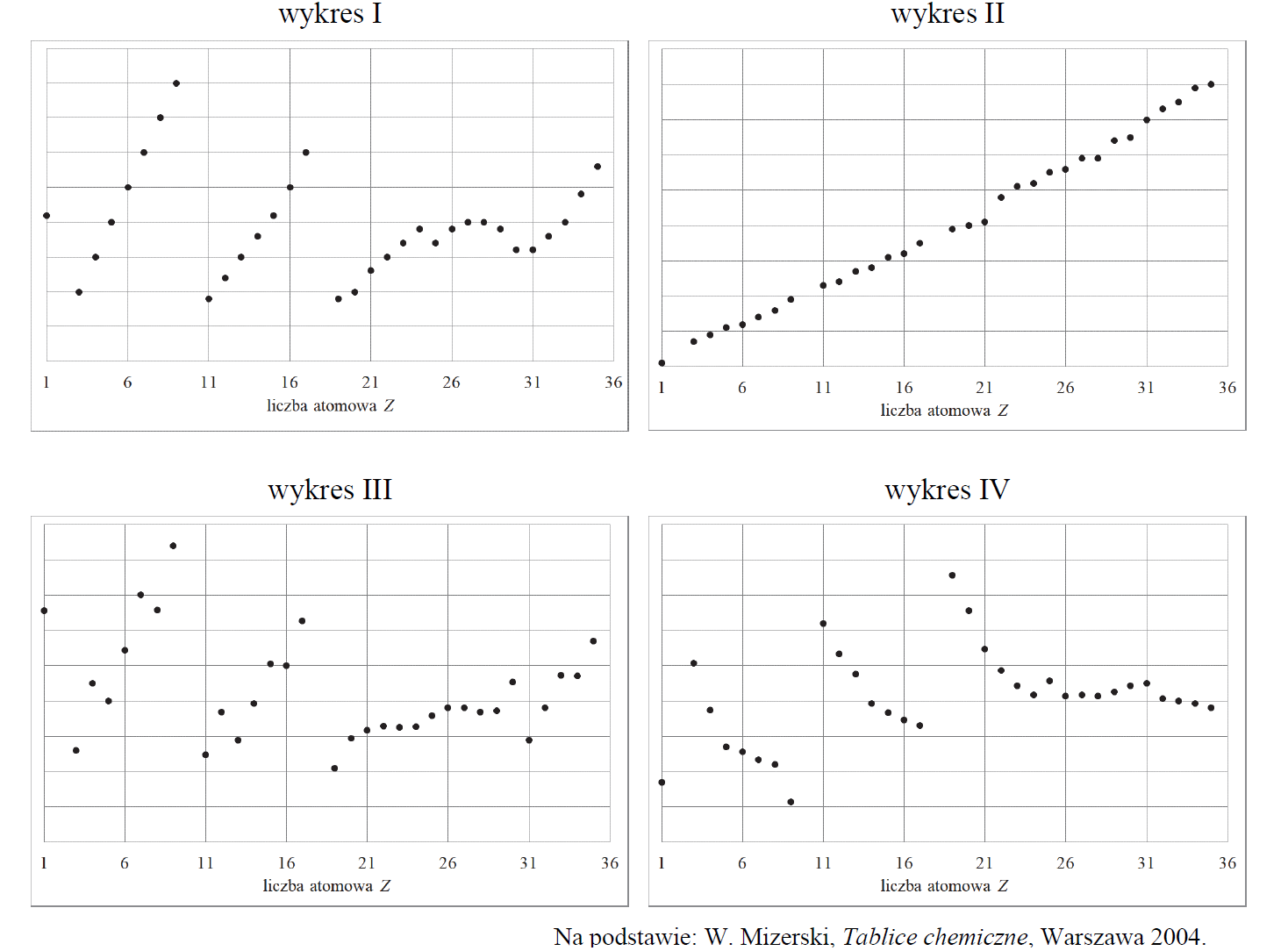
Podaj numer wykresu przedstawiającego zależność promienia atomowego od liczby atomowej i numer wykresu przedstawiającego zależność elektroujemności pierwiastków w skali Paulinga od liczby atomowej. Numer wykresu przedstawiającego zależność promienia atomowego od liczby atomowej:
Numer wykresu przedstawiającego zależność elektroujemności w skali Paulinga od liczby atomowej:
Klasyfikacja substancji pod względem rodzaju tworzonych kryształów. Zadanie 4.1. Arkusz CKE chemia maj 2020 rozszerzony (1 punkt)
Ciała stałe można podzielić na krystaliczne i bezpostaciowe. Kryształy klasyfikuje się ze względu na rodzaj oddziaływań między tworzącymi je drobinami. Wyróżnia się kryształy metaliczne, jonowe, kowalencyjne i molekularne.
Na podstawie: K. Pigoń, Z. Ruziewicz, Chemia fizyczna. Fizykochemia molekularna, Warszawa 2005.
Poniżej wymieniono nazwy siedmiu substancji tworzących kryształy w stałym stanie skupienia.
chlorek sodu, glin, glukoza, jod, sód, tlenek magnezu, wodorotlenek sodu
Spośród wymienionych substancji wybierz wszystkie te, które tworzą kryształy jonowe, oraz wszystkie te, które tworzą kryształy metaliczne. Wpisz ich nazwy we właściwe miejsce w tabeli.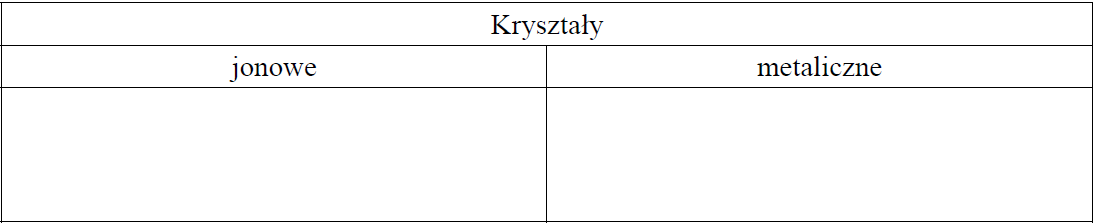
Opis przyczyny przewodnictwa elektrycznego. Zadanie 4.2. Arkusz CKE chemia maj 2020 rozszerzony (1 punkt)
Ciała stałe można podzielić na krystaliczne i bezpostaciowe. Kryształy klasyfikuje się ze względu na rodzaj oddziaływań między tworzącymi je drobinami. Wyróżnia się kryształy metaliczne, jonowe, kowalencyjne i molekularne.
Na podstawie: K. Pigoń, Z. Ruziewicz, Chemia fizyczna. Fizykochemia molekularna, Warszawa 2005.
Uzupełnij poniższe zdania. W odpowiedzi uwzględnij rodzaj nośników ładunku.
W kryształach metalicznych nośnikami ładunku są: , dlatego metale przewodzą prąd elektryczny w stałym stanie skupienia. Związki jonowe po stopieniu przewodzą prąd elektryczny, ponieważ .
Orbitale walencyjne w cząsteczce fosgenu. Zadanie 5. Arkusz CKE chemia maj 2020 rozszerzony (1 punkt)
Fosgen to trujący związek o wzorze COCl2. Jego temperatura topnienia jest równa –118 °C, a temperatura wrzenia wynosi 8 °C (pod ciśnieniem 1000 hPa). Fosgen reaguje z wodą i ulega hydrolizie, której produktami są tlenek węgla(IV) i chlorowodór.
Na podstawie: P. Mastalerz, Chemia organiczna, Warszawa 1986.
Uzupełnij informacje dotyczące struktury elektronowej cząsteczki fosgenu. Wybierz i podkreśl jedną odpowiedź spośród podanych w każdym nawiasie.
Orbitalom walencyjnym atomu węgla przypisuje się hybrydyzację (sp / sp2 / sp3). Orientacja przestrzenna tych orbitali powoduje, że cząsteczka fosgenu (jest / nie jest) płaska. Wiązanie π w tej cząsteczce tworzą orbital walencyjny (s / p / zhybrydyzowany) atomu węgla i orbital walencyjny p atomu tlenu.
Zapis równania reakcji hydrolizy fosgenu. Zadanie 6. Arkusz CKE chemia maj 2020 rozszerzony (1 punkt)
Fosgen to trujący związek o wzorze COCl2. Jego temperatura topnienia jest równa –118 °C, a temperatura wrzenia wynosi 8 °C (pod ciśnieniem 1000 hPa). Fosgen reaguje z wodą i ulega hydrolizie, której produktami są tlenek węgla(IV) i chlorowodór.
Na podstawie: P. Mastalerz, Chemia organiczna, Warszawa 1986.
Napisz równanie reakcji hydrolizy fosgenu.
Obliczanie gęstości fosgenu w określonych warunkach ciśnienia i temperatury. Zadanie 7. Arkusz CKE chemia maj 2020 rozszerzony (2 punkty)
Fosgen to trujący związek o wzorze COCl2. Jego temperatura topnienia jest równa –118 °C, a temperatura wrzenia wynosi 8 °C (pod ciśnieniem 1000 hPa). Fosgen reaguje z wodą i ulega hydrolizie, której produktami są tlenek węgla(IV) i chlorowodór.
Na podstawie: P. Mastalerz, Chemia organiczna, Warszawa 1986.
W temperaturze 25 °C i pod ciśnieniem 1000 hPa w 1 dm3 fosgenu znajduje się 2,43∙1022 cząsteczek tego związku.
Oblicz gęstość fosgenu i określ jego stan skupienia w opisanych warunkach.
Zapis jonowy skrócony równania reakcji utleniania metanalu jodem w środowisku zasadowym. Zadanie 8. Arkusz CKE chemia maj 2020 rozszerzony (1 punkt)
W środowisku alkalicznym jod utlenia ilościowo metanal do kwasu metanowego. Czynnikiem utleniającym jest anion jodanowy(I), który powstaje w reakcji jodu cząsteczkowego z anionami hydroksylowymi. Przebieg opisanych przemian można zilustrować następującymi równaniami:
reakcja 1.: I2 + 2OH− → IO− + I− + H2O
reakcja 2.: HCHO + IO− + OH− → HCOO− + I− + H2O
Na podstawie: J. Minczewski, Z. Marczenko, Chemia analityczna 2. Chemiczne metody analizy ilościowej, Warszawa 1998.
Napisz w formie jonowej skróconej sumaryczne równanie opisanego utleniania metanalu jodem w środowisku alkalicznym i określ stosunek masowy, w jakim metanal reaguje z jodem. Równanie reakcji: Stosunek masowy metanalu i jodu mHCHO : mI2:
Obliczanie rozpuszczalności węglanu sodu na podstawie rozpuszczalności hydratu tej soli. Zadanie 9. Arkusz CKE chemia maj 2020 rozszerzony (2 punkty)
Węglan sodu jest solą dość dobrze rozpuszczalną w wodzie. Podczas ochładzania jej gorącego roztworu nie powstaje sól bezwodna, ale wydzielają się hydraty, których skład zależy od temperatury. W temperaturze 20 °C w równowadze z roztworem nasyconym pozostaje dekahydrat o wzorze Na2CO3∙10 H2O. Rozpuszczalność dekahydratu węglanu sodu w wodzie w tej temperaturze jest równa 21,5 g w 100 g wody.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 1997.
Oblicz rozpuszczalność węglanu sodu (wyrażoną w gramach substancji na 100 gramów wody) w opisanych warunkach w przeliczeniu na sól bezwodną.
Określanie efektu cieplnego reakcji utleniania tlenku azotu(II). Zadanie 10. Arkusz CKE chemia maj 2020 rozszerzony (1 punkt)
Przemysłowa produkcja kwasu azotowego(V) jest procesem kilkuetapowym. Pierwszym etapem jest katalityczne utlenienie amoniaku tlenem z powietrza do tlenku azotu(II). W drugim etapie otrzymany tlenek azotu(II) utlenia się do tlenku azotu(IV). Ta reakcja przebiega zgodnie z poniższym równaniem:
![]()
Powstały tlenek azotu(IV) jest następnie wprowadzany do wody, w wyniku czego powstaje roztwór kwasu azotowego(V) o stężeniu w zakresie 50%–60% (w procentach masowych).
Na podstawie: K. Schmidt-Szałowski, M. Szafran, E. Bobryk, J. Sentek, Technologia chemiczna. Przemysł nieorganiczny, Warszawa 2013.
Na poniższym wykresie przedstawiono zależność równowagowego stopnia przemiany NO w NO2 od temperatury dla dwóch różnych wartości ciśnienia p1 i p2. Wydajność tworzenia NO2 jest tym większa, im większa jest wartość równowagowego stopnia przemiany.
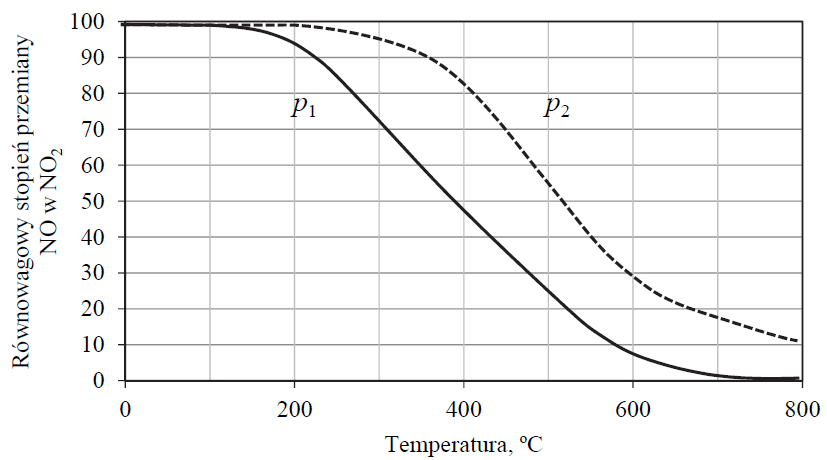
Uzupełnij poniższe zdania. Wybierz i podkreśl jedną odpowiedź spośród podanych w każdym nawiasie.
Ciśnienie p1 jest (wyższe / niższe) od ciśnienia p2. Przemiana NO w NO2 to reakcja (endotermiczna / egzotermiczna), co oznacza, że wartość ΔH tej przemiany jest (dodatnia / ujemna).
Zapis równania reakcji tlenku azotu(IV) z wodą oraz wskazanie utleniacza i reduktora. Zadanie 11. Arkusz CKE chemia maj 2020 rozszerzony (1 punkt)
Przemysłowa produkcja kwasu azotowego(V) jest procesem kilkuetapowym. Pierwszym etapem jest katalityczne utlenienie amoniaku tlenem z powietrza do tlenku azotu(II). W drugim etapie otrzymany tlenek azotu(II) utlenia się do tlenku azotu(IV). Ta reakcja przebiega zgodnie z poniższym równaniem:
![]()
Powstały tlenek azotu(IV) jest następnie wprowadzany do wody, w wyniku czego powstaje roztwór kwasu azotowego(V) o stężeniu w zakresie 50%–60% (w procentach masowych).
Na podstawie: K. Schmidt-Szałowski, M. Szafran, E. Bobryk, J. Sentek, Technologia chemiczna. Przemysł nieorganiczny, Warszawa 2013.
Napisz równanie opisanej reakcji tlenku azotu(IV) z wodą, której produktami są kwas azotowy(V) i tlenek azotu(II). Napisz wzór reduktora i wzór utleniacza. Wzór reduktora: Wzór utleniacza:
Równanie reakcji:
Obliczanie wartości stałej równowagi reakcji dimeryzacji tlenku azotu(IV). Zadanie 12. Arkusz CKE chemia maj 2020 rozszerzony (2 punkty)
Do zbiornika, z którego wypompowano powietrze, wprowadzono tlenek azotu(IV) o wzorze NO2 i po zamknięciu utrzymywano temperaturę 25 °C do momentu osiągnięcia przez układ stanu równowagi opisanej poniższym równaniem:
2NO2 ⇄ N2O4 ΔH < 0
Zmiany stężenia obu reagentów przedstawiono na poniższym wykresie.
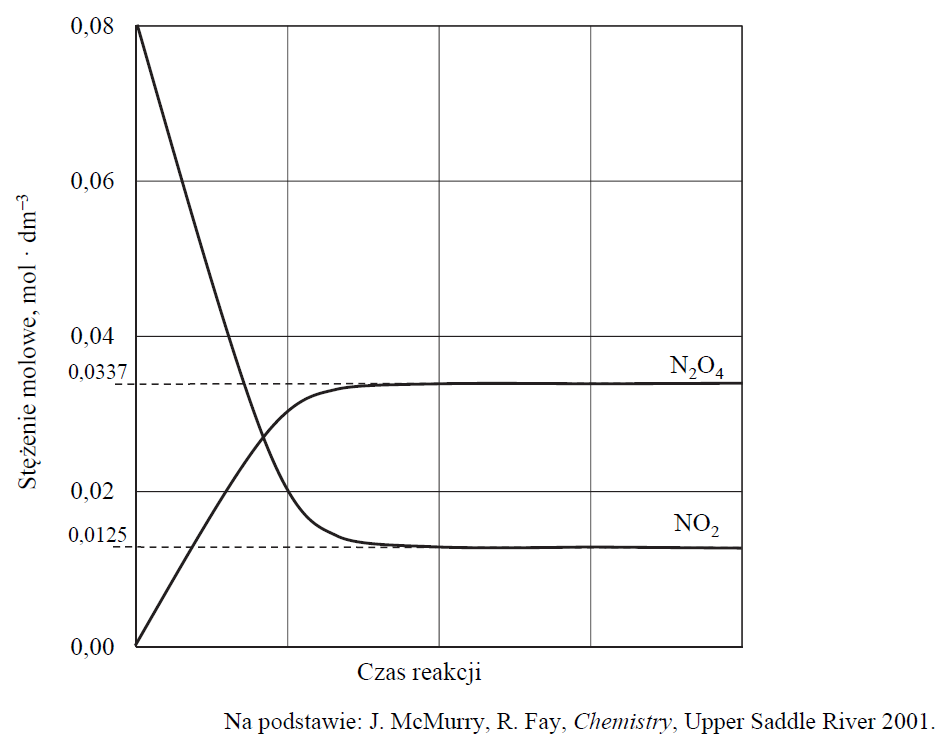
Oblicz stężeniową stałą równowagi opisanej reakcji w temperaturze 25 °C oraz uzupełnij zdanie – wybierz i podkreśl jedną odpowiedź spośród podanych w nawiasie. Stężeniowa stała równowagi opisanej reakcji w temperaturze wyższej niż 25 °C jest (mniejsza niż / większa niż / taka sama jak) stężeniowa stała równowagi tej reakcji w temperaturze 25 °C.