Obliczanie składu mieszaniny poreakcyjnej uzyskanej w wyniku spalania amoniaku. Zadanie 4. Arkusz CKE chemia maj 2016 rozszerzony (2 punkty)
Do reaktora wprowadzono 1,0 mol amoniaku i 1,6 mola tlenu, a następnie przeprowadzono – w odpowiednich warunkach – reakcję zilustrowaną poniższym równaniem.
![]()
Wykonaj obliczenia i podaj skład mieszaniny poreakcyjnej wyrażony w molach. Załóż, że opisana przemiana przebiegła z wydajnością równą 100%.
Określenie, czy układ oddaje energię do otoczenia, czy ją przyjmuje. Zadanie 5. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
W wyniku pewnej odwracalnej reakcji chemicznej z dwóch substratów powstaje jeden produkt. Przemiana przebiega w fazie gazowej, co oznacza, że oba substraty i produkt są gazami. Reakcję tę przeprowadzono w zamkniętym reaktorze przy użyciu stechiometrycznych ilości substratów w różnych temperaturach i pod różnym ciśnieniem. Na poniższym diagramie przedstawiono, jaki procent objętości mieszaniny poreakcyjnej w reaktorze stanowiła objętość produktu tej reakcji w zależności od warunków temperatury i ciśnienia, w jakich przebiegała.
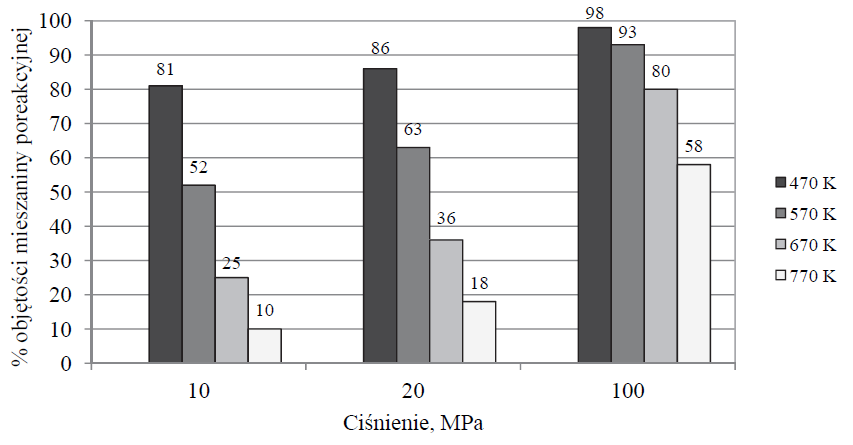
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Na podstawie analizy diagramu określ, czy w czasie opisanej reakcji układ oddaje energię do otoczenia, czy przyjmuje ją od otoczenia. Odpowiedź uzasadnij.
Określenie, czy liczba moli substratów jest większa, równa, bądź mniejsza od liczby moli produktów. Zadanie 6. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
W wyniku pewnej odwracalnej reakcji chemicznej z dwóch substratów powstaje jeden produkt. Przemiana przebiega w fazie gazowej, co oznacza, że oba substraty i produkt są gazami. Reakcję tę przeprowadzono w zamkniętym reaktorze przy użyciu stechiometrycznych ilości substratów w różnych temperaturach i pod różnym ciśnieniem. Na poniższym diagramie przedstawiono, jaki procent objętości mieszaniny poreakcyjnej w reaktorze stanowiła objętość produktu tej reakcji w zależności od warunków temperatury i ciśnienia, w jakich przebiegała.

Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Na podstawie analizy diagramu określ, czy w równaniu stechiometrycznym opisanej reakcji łączna liczba moli substratów jest mniejsza, czy – większa od liczby moli produktu, czy też – równa liczbie moli produktu. Odpowiedź uzasadnij.
Wybór właściwego równania reakcji chemicznej na podstawie diagramu opisującego zawartość reagenta w zależności od ciśnienia i temperatury. Zadanie 7. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
W wyniku pewnej odwracalnej reakcji chemicznej z dwóch substratów powstaje jeden produkt. Przemiana przebiega w fazie gazowej, co oznacza, że oba substraty i produkt są gazami. Reakcję tę przeprowadzono w zamkniętym reaktorze przy użyciu stechiometrycznych ilości substratów w różnych temperaturach i pod różnym ciśnieniem. Na poniższym diagramie przedstawiono, jaki procent objętości mieszaniny poreakcyjnej w reaktorze stanowiła objętość produktu tej reakcji w zależności od warunków temperatury i ciśnienia, w jakich przebiegała.

Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Spośród reakcji, których równania przedstawiono poniżej, wybierz tę, do której mógłby odnosić się przedstawiony diagram. Zaznacz wybraną odpowiedź. 1. H2 (g) + Cl2 (g) → 2HCl (g) ΔH < 0 2. H2 (g) + I2 (g) → 2HI (g) ΔH > 0 3. N2 (g) + 3H2 (g) → 2NH3 (g) ΔH < 0 4. 2Cl2 (g) + O2 (g) → 2Cl2O (g) ΔH > 0
Obliczanie stopnia dysocjacji amoniaku. Zadanie 8. Arkusz CKE chemia maj 2016 rozszerzony (2 punkty)
Amoniak bardzo dobrze rozpuszcza się wodzie, a w powstałym roztworze zachodzi reakcja opisana równaniem:
NH3 + H2O ⇄ NH4+ + OH–
Oblicz, jaki procent wszystkich wprowadzonych do wody cząsteczek amoniaku ulega tej reakcji w wodnym roztworze amoniaku o stężeniu 0,1 mol·dm–3 w temperaturze 298 K. Przyjmij, że (w opisanych warunkach) reakcji ulega mniej niż 5% wprowadzonych do wody cząsteczek amoniaku.
Wybór odpowiedniego odczynnika do reakcji z tlenkiem baru. Zadanie 9.1. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
Aby potwierdzić zasadowy charakter tlenku baru, przeprowadzano reakcję tego tlenku z pewnym odczynnikiem w obecności wskaźnika pH, którym była czerwień bromofenolowa. Wskaźnik ten w roztworach o pH < 5,2 ma barwę żółtą, a w roztworach o pH > 6,8 przyjmuje barwę czerwoną. W roztworach o 5,2 < pH < 6,8 barwi się na kolor pośredni między żółtym a czerwonym (różne odcienie barwy pomarańczowej).
Do probówki wprowadzono wybrany odczynnik z dodatkiem czerwieni bromofenolowej, a następnie dodano nadmiar stałego tlenku baru, dokładnie mieszając jej zawartość. Zaobserwowano, że dodany tlenek baru roztworzył się całkowicie, a powstały w probówce klarowny roztwór zmienił zabarwienie.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Uzupełnij poniższy schemat wykonania doświadczenia. Wpisz wzór odczynnika wybranego spośród następujących: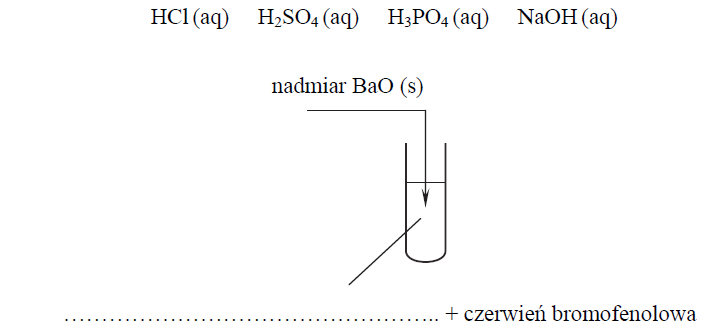
Opis zabarwienia zawartości probówki przed i po wprowadzeniu tlenku baru. Zadanie 9.2. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
Aby potwierdzić zasadowy charakter tlenku baru, przeprowadzano reakcję tego tlenku z pewnym odczynnikiem w obecności wskaźnika pH, którym była czerwień bromofenolowa. Wskaźnik ten w roztworach o pH < 5,2 ma barwę żółtą, a w roztworach o pH > 6,8 przyjmuje barwę czerwoną. W roztworach o 5,2 < pH < 6,8 barwi się na kolor pośredni między żółtym a czerwonym (różne odcienie barwy pomarańczowej).
Do probówki wprowadzono wybrany odczynnik z dodatkiem czerwieni bromofenolowej, a następnie dodano nadmiar stałego tlenku baru, dokładnie mieszając jej zawartość. Zaobserwowano, że dodany tlenek baru roztworzył się całkowicie, a powstały w probówce klarowny roztwór zmienił zabarwienie.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Wybierz opisany odczynnik spośród:
![]()
Napisz, jakie było zabarwienie zawartości probówki przed wprowadzeniem tlenku baru i po jego wprowadzeniu do roztworu znajdującego się w probówce.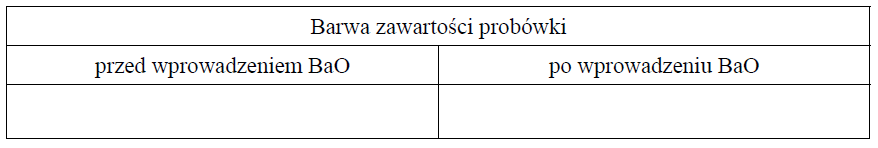
Zapis równań reakcji połówkowych z wykorzystaniem bilansu jonowo-elektronowego bez określania stopni utlenienia. Zadanie 10.1. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
Jednym z tlenowych kwasów siarki jest kwas trioksotiosiarkowy (nazwa zwyczajowa: kwas tiosiarkowy) o wzorze H2S2O3. Anion S2O32– (tiosiarczanowy) ma strukturę analogiczną do struktury jonu siarczanowego(VI), z tą różnicą, że zamiast jednego atomu tlenu zawiera atom siarki. Centralnemu atomowi siarki w jonie S2O32– odpowiada stopień utlenienia (VI), a skrajnemu – stopień utlenienia (–II). Kwas tiosiarkowy jest substancją nietrwałą, trwałe są natomiast sole tego kwasu – tiosiarczany. Spośród tych soli największe znaczenie ma tiosiarczan sodu – zwykle występujący jako pentahydrat o wzorze Na2S2O3 · 5H2O. Znajduje on zastosowanie w przemyśle włókienniczym jako substancja służąca do usuwania resztek chloru używanego do bielenia tkanin. Podczas zachodzącej reakcji chlor utlenia jony S2O32– do jonów siarczanowych(VI). W przemianie tej udział bierze również woda.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004.
Napisz w formie jonowej z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy) równanie reakcji redukcji i równanie reakcji utleniania zachodzących podczas procesu usuwania resztek chloru użytego do bielenia tkanin za pomocą jonów tiosiarczanowych. Uwzględnij, że w przemianie bierze udział woda. Równanie reakcji redukcji: Równanie reakcji utleniania:
Zapis w formie jonowej skróconej równania reakcji chemicznej. Zadanie 10.2. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
Jednym z tlenowych kwasów siarki jest kwas trioksotiosiarkowy (nazwa zwyczajowa: kwas tiosiarkowy) o wzorze H2S2O3. Anion S2O32– (tiosiarczanowy) ma strukturę analogiczną do struktury jonu siarczanowego(VI), z tą różnicą, że zamiast jednego atomu tlenu zawiera atom siarki. Centralnemu atomowi siarki w jonie S2O32– odpowiada stopień utlenienia (VI), a skrajnemu – stopień utlenienia (–II). Kwas tiosiarkowy jest substancją nietrwałą, trwałe są natomiast sole tego kwasu – tiosiarczany. Spośród tych soli największe znaczenie ma tiosiarczan sodu – zwykle występujący jako pentahydrat o wzorze Na2S2O3 · 5H2O. Znajduje on zastosowanie w przemyśle włókienniczym jako substancja służąca do usuwania resztek chloru używanego do bielenia tkanin. Podczas zachodzącej reakcji chlor utlenia jony S2O32– do jonów siarczanowych(VI). W przemianie tej udział bierze również woda.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004.
Napisz w formie jonowej skróconej sumaryczne równanie opisanej reakcji usuwania chloru.
Obliczanie ilości wody jaką należy wprowadzić do nasyconego roztworu w celu uzyskania roztworu o określonym stężeniu. Zadanie 11. Arkusz CKE chemia maj 2016 rozszerzony (2 punkty)
Jednym z tlenowych kwasów siarki jest kwas trioksotiosiarkowy (nazwa zwyczajowa: kwas tiosiarkowy) o wzorze H2S2O3. Anion S2O32– (tiosiarczanowy) ma strukturę analogiczną do struktury jonu siarczanowego(VI), z tą różnicą, że zamiast jednego atomu tlenu zawiera atom siarki. Centralnemu atomowi siarki w jonie S2O32– odpowiada stopień utlenienia (VI), a skrajnemu – stopień utlenienia (–II). Kwas tiosiarkowy jest substancją nietrwałą, trwałe są natomiast sole tego kwasu – tiosiarczany. Spośród tych soli największe znaczenie ma tiosiarczan sodu – zwykle występujący jako pentahydrat o wzorze Na2S2O3 · 5H2O. Znajduje on zastosowanie w przemyśle włókienniczym jako substancja służąca do usuwania resztek chloru używanego do bielenia tkanin. Podczas zachodzącej reakcji chlor utlenia jony S2O32– do jonów siarczanowych(VI). W przemianie tej udział bierze również woda.
W temperaturze 20 oC rozpuszczalność pentahydratu tiosiarczanu sodu wynosi 176 gramów w 100 gramach wody.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004 oraz W. Mizerski, Tablice chemiczne, Warszawa 2003.
Oblicz, ile gramów wody należy dodać do 100 gramów nasyconego w temperaturze 20 oC wodnego roztworu tiosiarczanu sodu, aby uzyskać roztwór o stężeniu 25% masowych. W obliczeniach zastosuj wartości masy molowej reagentów zaokrąglone do jedności. Wynik końcowy zaokrąglij do jedności.
Wybór wskaźników alkacymetrycznych zastosowanych do odróżnienia roztworów. Zadanie 12. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
Zmiana barwy wskaźników pH następuje stopniowo, w pewnym zakresie pH. W tabeli podano zakres pH, w którym następuje zmiana barwy wybranych wskaźników kwasowo-zasadowych.
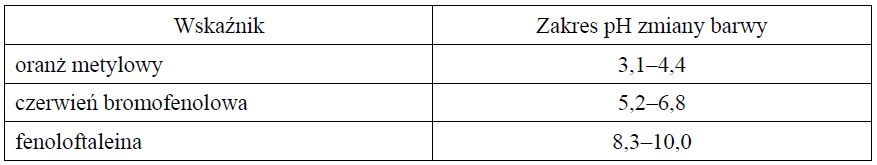
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004.
Spośród wymienionych wskaźników: oranż metylowy, czerwień bromofenolowa i fenoloftaleina, wybierz i zaznacz nazwy wszystkich tych, które mogą być użyte w celu odróżnienia: 1. dwóch wodnych roztworów, z których jeden ma pH = 5, a drugi ma pH = 7 oranż metylowy czerwień bromofenolowa fenoloftaleina 2. kwasu solnego o stężeniu 0,01 mol⋅dm–3 od wodnego roztworu wodorotlenku sodu o stężeniu 0,01 mol⋅dm–3. oranż metylowy czerwień bromofenolowa fenoloftaleina
Wskazanie analitu oraz titranta i określenie odczynu roztworu w punkcie równoważnikowym miareczkowania. Zadanie 13. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
Przeprowadzono doświadczenie, podczas którego do 10 cm3 wodnego roztworu wodorotlenku sodu dodawano kroplami wodny roztwór pewnego elektrolitu o stężeniu cm = 0,1 mol · dm–3, mierząc pH mieszaniny reakcyjnej. Przebieg doświadczenia zilustrowano schematem.
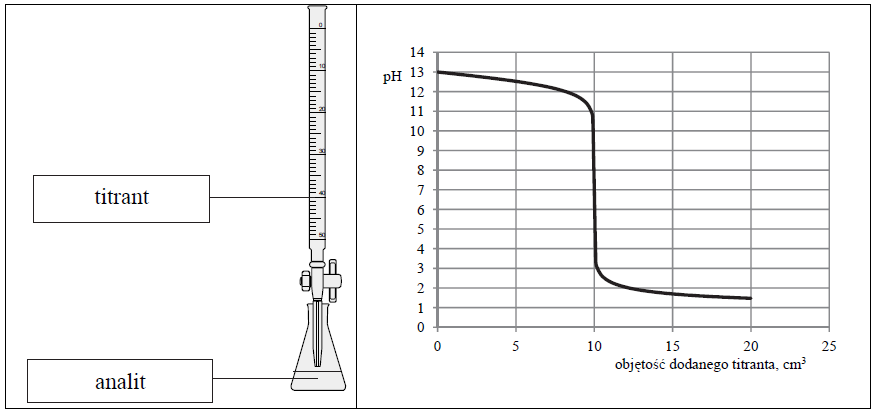
Opisane doświadczenie jest przykładem miareczkowania alkacymetrycznego (kwasowo-zasadowego), które polega na dodawaniu z biurety roztworu, nazywanego titrantem, do kolby z próbką, nazywaną analitem. W miareczkowaniu wykorzystuje się
stechiometryczną zależność między substancjami obecnymi w analicie i titrancie.
Odczytana z wykresu wartość pH roztworu otrzymanego po zmieszaniu roztworów zawierających stechiometryczne ilości reagentów jest równa 7.
Uzupełnij poniższe zdania. Podkreśl właściwy odczyn roztworu, a w miejsca kropek wpisz odpowiednie wzory związków. Można stwierdzić, że otrzymany roztwór, który powstał po zmieszaniu roztworów zawierających stechiometryczne ilości reagentów, miał odczyn Informacje te pozwalają na jednoznaczny wybór spośród wodnych roztworów elektrolitów:
(kwasowy / obojętny / zasadowy) oraz że analitem był wodny roztwór .
HCOOH (aq), CH3COOH (aq), HCl (aq), NH3 (aq), NaOH (aq)
związku, którego wodny roztwór pełnił podczas opisanego doświadczenia funkcję titranta. Związek ten ma wzór .
Wskazanie barwy roztworu w zależności od objętości wprowadzonego roztworu titranta. Zadanie 14. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
Przeprowadzono doświadczenie, podczas którego do 10 cm3 wodnego roztworu wodorotlenku sodu dodawano kroplami wodny roztwór pewnego elektrolitu o stężeniu cm = 0,1 mol · dm–3, mierząc pH mieszaniny reakcyjnej. Przebieg doświadczenia zilustrowano schematem.

Opisane doświadczenie jest przykładem miareczkowania alkacymetrycznego (kwasowo-zasadowego), które polega na dodawaniu z biurety roztworu, nazywanego titrantem, do kolby z próbką, nazywaną analitem. W miareczkowaniu wykorzystuje się
stechiometryczną zależność między substancjami obecnymi w analicie i titrancie.
Odczytana z wykresu wartość pH roztworu otrzymanego po zmieszaniu roztworów zawierających stechiometryczne ilości reagentów jest równa 7.
Na podstawie analizy wykresu określ, jaką barwę przyjąłby żółty uniwersalny papierek wskaźnikowy, gdyby podczas przeprowadzanego doświadczenia został on zanurzony w roztworze, do którego dodano: 5 cm3, 10 cm3 oraz 15 cm3 titranta. Barwa wskaźnika po dodaniu 5 cm3 titranta: Barwa wskaźnika po dodaniu 10 cm3 titranta: Barwa wskaźnika po dodaniu 15 cm3 titranta:
Wybór właściwych odczynników w celu wykonania doświadczenia chemicznego. Zadanie 16.1. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
W wyniku niektórych reakcji chemicznych powstają mieszaniny niejednorodne. Zaprojektuj doświadczenie prowadzące do powstania niejednorodnej mieszaniny, w której skład wchodzi wodny roztwór kwasu siarkowego(VI).
Uzupełnij schemat doświadczenia. Wybierz i zaznacz po jednym wzorze odczynnika w zestawach I i II.

