Wybór nieczynnych optycznie związków chemicznych z uzasadnieniem wyboru. Zadanie 26. Arkusz CKE chemia maj 2016 rozszerzony (2 punkty)
Poniżej przedstawiono wzory stereochemiczne Fischera trzech związków organicznych. Dwa z nich nie są optycznie czynne – ich cząsteczki nie są chiralne.
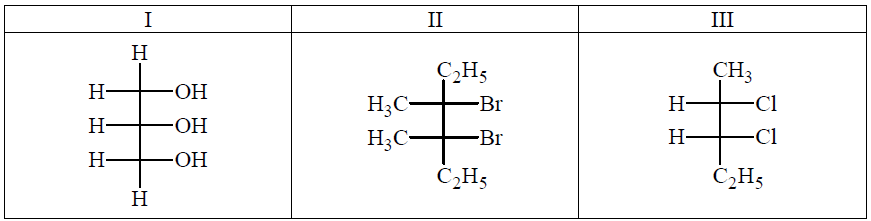
Spośród podanych wzorów związków chemicznych wybierz wzory tych, które nie są optycznie czynne. Wpisz do poniższej tabeli numery, którymi oznaczono te związki, i w każdym przypadku uzasadnij swój wybór.
Zapis równania reakcji chemicznej na podstawie schematu ciągu przemian. Zadanie 27. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
Przeprowadzono ciąg przemian opisany poniższym schematem.
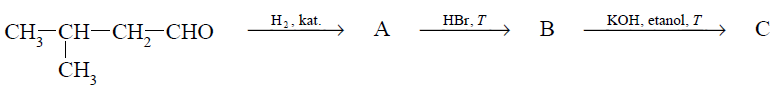
Napisz równanie reakcji prowadzącej do otrzymania produktu A. Zastosuj wzory półstrukturalne (grupowe) związków organicznych.
Zapis grupowy wzoru związku chemicznego oraz określenie typu reakcji chemicznej. Zadanie 28. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
Przeprowadzono ciąg przemian opisany poniższym schematem.
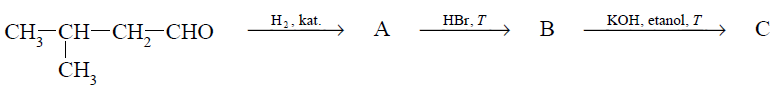
Uzupełnij poniższą tabelę. Podaj wzór półstrukturalny (grupowy) związku organicznego oznaczonego na schemacie literą B. Określ typ reakcji (addycja, eliminacja, substytucja), w wyniku której powstaje związek C.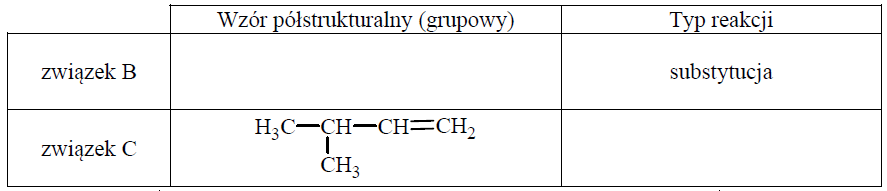
Rysowanie wzoru izomeru trans aldehydu cynamonowego. Zadanie 29. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
Aldehyd cynamonowy to związek o wzorze:
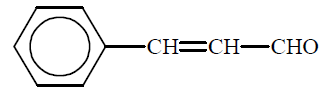
Aldehyd ten występuje w przyrodzie w konfiguracji trans.
Napisz wzór izomeru trans aldehydu cynamonowego.
Zapis obserwacji na podstawie doświadczenia przeprowadzonego z udziałem aldehydu cynamonowego. Zadanie 30. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
W celu zbadania właściwości aldehydu cynamonowego wykonano eksperyment, którego przebieg zilustrowano na rysunku.
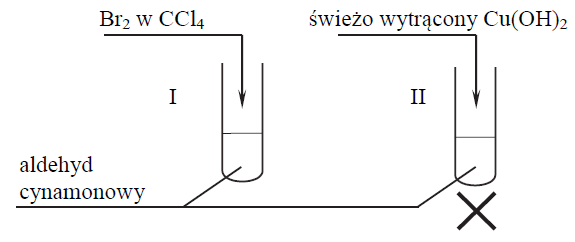
Porównaj przebieg reakcji w obu probówkach. Dokończ poniższe zdania – wybierz i podkreśl właściwe opisy spostrzeżeń spośród podanych w nawiasach. 1. Po dodaniu odczynnika do probówki I zaobserwowano, że roztwór bromu (uległ odbarwieniu / zabarwił się na fioletowo / nie zmienił zabarwienia). 2. W probówce II w wyniku ogrzewania zawiesiny wodorotlenku miedzi(II) z aldehydem cynamonowym powstał (szafirowy roztwór / ceglasty osad / różowy roztwór).
Obliczanie wartości pH roztworu. Zadanie 31. Arkusz CKE chemia maj 2016 rozszerzony (2 punkty)
Przygotowano dwa wodne roztwory kwasu metanowego (mrówkowego) o temperaturze t = 20 oC: roztwór pierwszy o pH = 1,9 i roztwór drugi o nieznanym pH. Stopień dysocjacji kwasu w roztworze pierwszym jest równy 1,33%, a w roztworze drugim wynosi 4,15%.
Na podstawie: Z. Dobkowska, K. Pazdro, Szkolny poradnik chemiczny, Warszawa 1990.
Oblicz pH roztworu, w którym stopień dysocjacji kwasu metanowego jest równy 4,15%. Wynik końcowy zaokrąglij do pierwszego miejsca po przecinku. Oceń, czy wyższa wartość stopnia dysocjacji kwasu w roztworze oznacza, że roztwór ten ma bardziej kwasowy odczyn. Ocena:
Ustalenie wzoru związku chemicznego biorącego udział w reakcji estryfikacji z kwasem 2-hydroksypropanowym. Zadanie 32. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
Kwas 2-hydroksypropanowy w reakcji ze związkiem X tworzy ester o wzorze sumarycznym C5H8O4. Orbitalom walencyjnym każdego z atomów węgla budujących cząsteczkę związku X przypisuje się inny typ hybrydyzacji. Ponadto wiadomo, że w cząsteczce związku X występuje tylko jedna grupa funkcyjna.
Ustal wzór związku X, którego użyto do estryfikacji kwasu 2-hydroksypropanowego, i napisz równanie reakcji otrzymywania opisanego estru. Zastosuj wzory półstrukturalne (grupowe) związków organicznych.
Wskazanie enolowych oraz asymetrycznych atomów węgla w cząsteczce kwasu askorbinowego. Zadanie 33. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
W cząsteczce kwasu askorbinowego (witaminy C) występują dwa enolowe atomy węgla, czyli atomy węgla o hybrydyzacji sp2 z przyłączonymi grupami hydroksylowymi. Cząsteczka tego związku zawiera ponadto dwa asymetryczne atomy węgla – o hybrydyzacji sp3 z przyłączonymi czterema różnymi podstawnikami. Poniżej przedstawiono wzór witaminy C, w którym małymi literami oznaczono poszczególne atomy węgla.
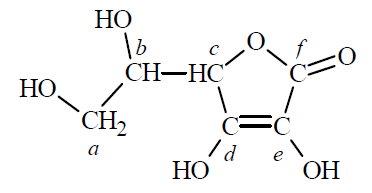
Napisz litery (a–f), którymi oznaczono w powyższym wzorze kwasu askorbinowego wszystkie enolowe atomy węgla oraz wszystkie asymetryczne atomy węgla. Enolowe atomy węgla: Asymetryczne atomy węgla:
Przypisanie stopni utlenienia wybranym atomom węgla w cząsteczce witaminy C. Zadanie 34. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
W cząsteczce kwasu askorbinowego (witaminy C) występują dwa enolowe atomy węgla, czyli atomy węgla o hybrydyzacji sp2 z przyłączonymi grupami hydroksylowymi. Cząsteczka tego związku zawiera ponadto dwa asymetryczne atomy węgla – o hybrydyzacji sp3 z przyłączonymi czterema różnymi podstawnikami. Poniżej przedstawiono wzór witaminy C, w którym małymi literami oznaczono poszczególne atomy węgla.

Określ formalne stopnie utlenienia atomów węgla oznaczonych w podanym wzorze kwasu askorbinowego literami a, b i f. Uzupełnij poniższą tabelę.
Wskazanie probówek, których zawartość uległa odbarwieniu po dodaniu roztworu witaminy C. Zadanie 35. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
W cząsteczce kwasu askorbinowego (witaminy C) występują dwa enolowe atomy węgla, czyli atomy węgla o hybrydyzacji sp2 z przyłączonymi grupami hydroksylowymi. Cząsteczka tego związku zawiera ponadto dwa asymetryczne atomy węgla – o hybrydyzacji sp3 z przyłączonymi czterema różnymi podstawnikami. Poniżej przedstawiono wzór witaminy C, w którym małymi literami oznaczono poszczególne atomy węgla.

W celu zbadania właściwości kwasu askorbinowego przeprowadzono doświadczenie, którego przebieg zilustrowano na poniższym rysunku.
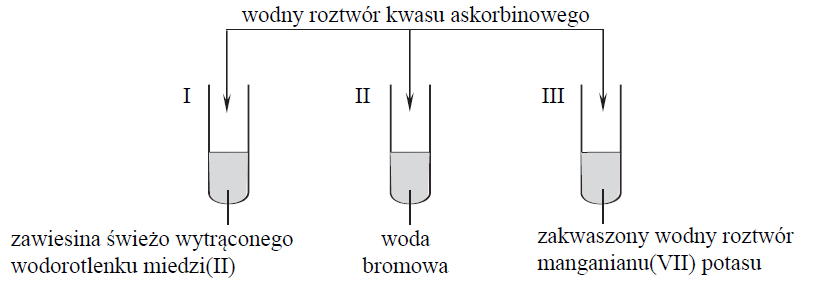
Przed dodaniem wodnego roztworu kwasu askorbinowego zawartość każdej probówki była barwna.
Napisz numery probówek, w których po dodaniu roztworu kwasu askorbinowego zaobserwowano odbarwianie się ich zawartości.
Ocena poprawności zdań dotyczących ciągu przemian kwasu askorbinowego w kwas dehydroaskorbinowy. Zadanie 36. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
Kwas askorbinowy ulega przemianie w kwas dehydroaskorbinowy zgodnie z poniższym schematem. Odszczepienie jednego protonu od cząsteczki witaminy C prowadzi do powstania anionu askorbinianowego (reakcja 1.). W wyniku oddania przez anion askorbinianowy elektronu i drugiego protonu powstaje rodnik askorbylowy (reakcja 2.). Wskutek utraty elektronu przez rodnik askorbylowy tworzy się kwas dehydroaskorbinowy (reakcja 3.).
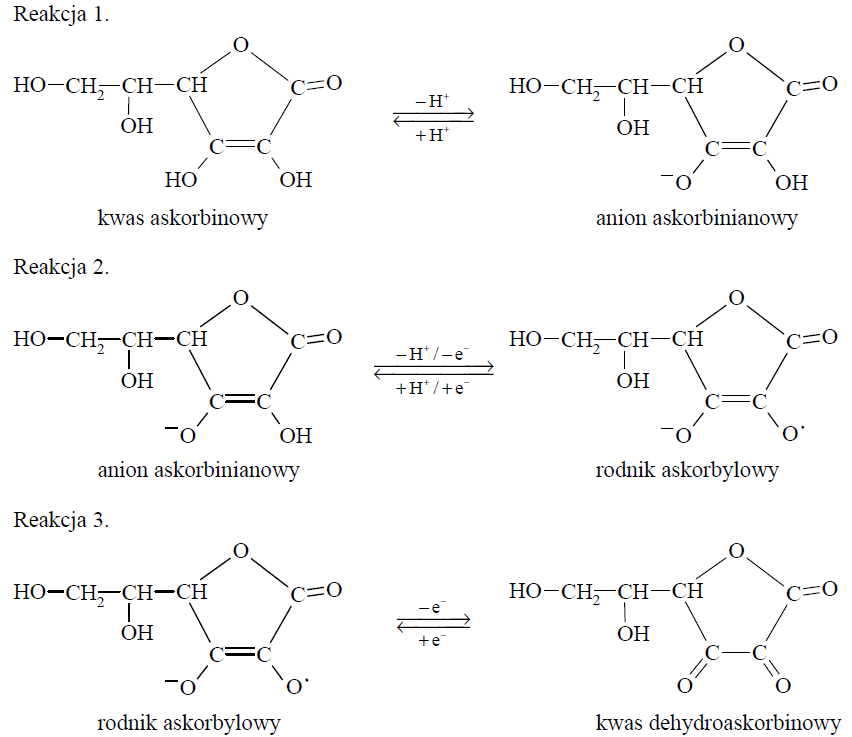
Na podstawie: J. Szymańska-Pasternak, A. Janicka, J. Bober, Witamina C jako oręż w walce z rakiem, „Onkologia w praktyce klinicznej”, 2011/1.
Oceń, czy poniższe informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa. 1. Anion askorbinianowy – w zależności od warunków reakcji – może przyłączać albo oddawać proton. 2. Rodnik askorbylowy jest reaktywny chemicznie, ponieważ występuje w nim jeden niesparowany elektron. 3. Kwas dehydroaskorbinowy jest produktem redukcji rodnika askorbylowego.
Zapis równań połówkowych reakcji utleniania oraz redukcji przebiegających podczas reakcji kwasu askorbinowego z tlenem. Zadanie 37. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
Kwas askorbinowy ulega przemianie w kwas dehydroaskorbinowy zgodnie z poniższym schematem. Odszczepienie jednego protonu od cząsteczki witaminy C prowadzi do powstania anionu askorbinianowego (reakcja 1.). W wyniku oddania przez anion askorbinianowy elektronu i drugiego protonu powstaje rodnik askorbylowy (reakcja 2.). Wskutek utraty elektronu przez rodnik askorbylowy tworzy się kwas dehydroaskorbinowy (reakcja 3.).

Na podstawie: J. Szymańska-Pasternak, A. Janicka, J. Bober, Witamina C jako oręż w walce z rakiem, „Onkologia w praktyce klinicznej”, 2011/1.
Poniżej przedstawiono schemat reakcji utleniania witaminy C tlenem z powietrza. Reakcja ta jest katalizowana przez enzym o nazwie oksydaza askorbinianowa.
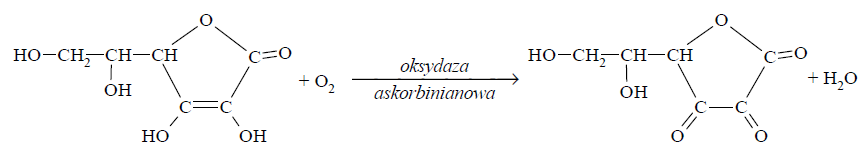
Napisz równanie procesu utleniania (uzupełnij schemat) i równanie procesu redukcji zachodzących podczas opisanej przemiany. Oba równania przedstaw w formie jonowej z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy). Równanie procesu utleniania: Równanie procesu redukcji: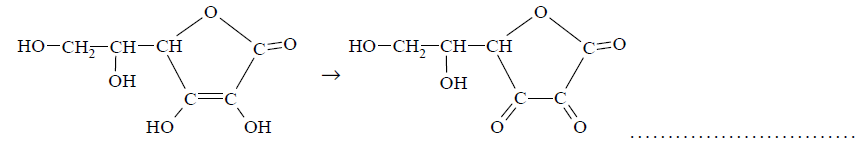
Zapis wzoru grupowego produktu reakcji kwasu askorbinowego z roztworem zasady sodowej. Zadanie 38. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
Kwas askorbinowy ulega przemianie w kwas dehydroaskorbinowy zgodnie z poniższym schematem. Odszczepienie jednego protonu od cząsteczki witaminy C prowadzi do powstania anionu askorbinianowego (reakcja 1.). W wyniku oddania przez anion askorbinianowy elektronu i drugiego protonu powstaje rodnik askorbylowy (reakcja 2.). Wskutek utraty elektronu przez rodnik askorbylowy tworzy się kwas dehydroaskorbinowy (reakcja 3.).

Na podstawie: J. Szymańska-Pasternak, A. Janicka, J. Bober, Witamina C jako oręż w walce z rakiem, „Onkologia w praktyce klinicznej”, 2011/1.
Roztwór wodny kwasu dehydroaskorbinowego ma odczyn obojętny. Kwas ten ulega jednak działaniu wodnych roztworów wodorotlenków metali, w wyniku czego tworzą się sole. W tej reakcji rozerwaniu ulega wiązanie estrowe, co prowadzi do otwarcia pierścienia cząsteczki.
Uzupełnij podany niżej schemat opisanej reakcji – wpisz wzór półstrukturalny (grupowy) jej organicznego produktu.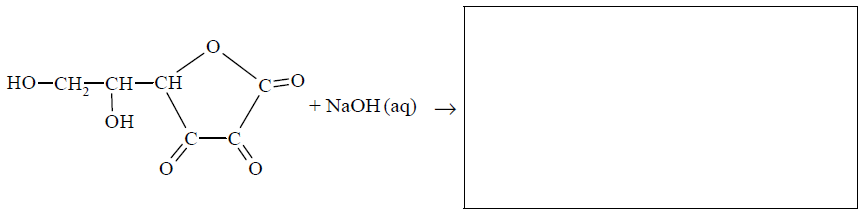
Zapis równań reakcji acetamidu z roztworem kwasu oraz zasady. Zadanie 39.1. Arkusz CKE chemia maj 2016 rozszerzony (2 punkty)
Mocznik jest diamidem kwasu węglowego. Ogrzewany z roztworami mocnych kwasów i z zasadami, ulega przemianom zilustrowanym poniższymi równaniami:
CO(NH2)2 + H2O + 2H+ → 2NH4+ + CO2
CO(NH2) 2 + 2OH− → CO32− + 2NH3
W celu porównania właściwości acetamidu i mocznika przeprowadzono dwa doświadczenia A i B zilustrowane na schemacie.
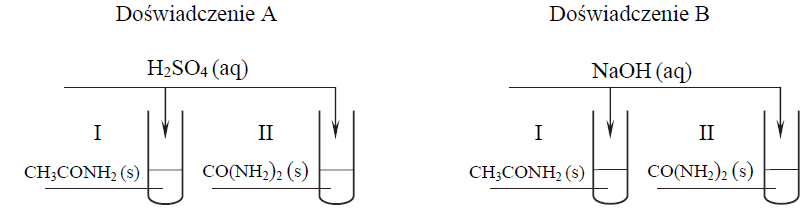
Po zmieszaniu reagentów zawartość każdej probówki ogrzano. Stwierdzono, że we wszystkich probówkach przebiegły reakcje chemiczne.
Napisz w formie jonowej skróconej równanie reakcji zachodzącej podczas ogrzewania acetamidu Doświadczenie A, probówka I: Doświadczenie B, probówka I:
• w wodnym roztworze kwasu siarkowego(VI) (doświadczenie A, probówka I)
• w wodnym roztworze wodorotlenku sodu (doświadczenie B, probówka I).
Wybór doświadczenia pozwalającego na odróżnienie acetamidu od mocznika wraz z uzasadnieniem wyboru. Zadanie 39.2. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
Mocznik jest diamidem kwasu węglowego. Ogrzewany z roztworami mocnych kwasów i z zasadami, ulega przemianom zilustrowanym poniższymi równaniami:
CO(NH2)2 + H2O + 2H+ → 2NH4+ + CO2
CO(NH2) 2 + 2OH− → CO32− + 2NH3
W celu porównania właściwości acetamidu i mocznika przeprowadzono dwa doświadczenia A i B zilustrowane na schemacie.

Po zmieszaniu reagentów zawartość każdej probówki ogrzano. Stwierdzono, że we wszystkich probówkach przebiegły reakcje chemiczne.
Oceń, które z przeprowadzonych doświadczeń (A czy B) można wykorzystać w celu odróżnienia acetamidu od mocznika, i uzasadnij swoje stanowisko. W uzasadnieniu odwołaj się do zmian możliwych do zaobserwowania w probówkach I i II (w wybranym doświadczeniu) i pozwalających na odróżnienie acetamidu od mocznika. W celu odróżnienia acetamidu od mocznika należy przeprowadzić doświadczenie: Uzasadnienie: Probówka I: Probówka II:

