Opis zawartości probówki przed i po wykonaniu doświadczenia. Zadanie 16.2. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
W wyniku niektórych reakcji chemicznych powstają mieszaniny niejednorodne. Zaprojektuj doświadczenie prowadzące do powstania niejednorodnej mieszaniny, w której skład wchodzi wodny roztwór kwasu siarkowego(VI).
Najpierw w zadaniu 16.1 należało wybrać odpowiednie odczynniki w celu wykonania doświadczenia:

Opisz obserwowane zmiany zawartości probówki podczas przeprowadzonego doświadczenia przy założeniu, że reagentów użyto w ilościach stechiometrycznych (należy opisać wygląd zawartości probówki przed dodaniem odczynnika z zestawu I oraz po zajściu reakcji chemicznej). Przed dodaniem odczynnika: Po zajściu reakcji:
Zapis w formie jonowej skróconej równania przebiegającej reakcji chemicznej. Zadanie 16.3. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
W wyniku niektórych reakcji chemicznych powstają mieszaniny niejednorodne. Zaprojektuj doświadczenie prowadzące do powstania niejednorodnej mieszaniny, w której skład wchodzi wodny roztwór kwasu siarkowego(VI).
Najpierw w zadaniu 16.1 należało wybrać odpowiednie odczynniki w celu wykonania doświadczenia:

Napisz w formie jonowej skróconej równanie reakcji zachodzącej podczas przeprowadzonego doświadczenia przy założeniu, że reagentów użyto w ilościach stechiometrycznych.
Wskazanie nazwy metody pozwalającej na rozdzielenie składników mieszaniny. Zadanie 16.4. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
W wyniku niektórych reakcji chemicznych powstają mieszaniny niejednorodne. Zaprojektuj doświadczenie prowadzące do powstania niejednorodnej mieszaniny, w której skład wchodzi wodny roztwór kwasu siarkowego(VI).
Najpierw w zadaniu 16.1 należało wybrać odpowiednie odczynniki w celu wykonania doświadczenia:

Podaj nazwę metody, którą należy zastosować w celu wyodrębnienia wodnego roztworu kwasu siarkowego(VI) z mieszaniny poreakcyjnej.
Zapis równania procesu decydującego o odczynie roztworu. Zadanie 17. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
Przeprowadzono doświadczenie zilustrowane poniższym schematem.
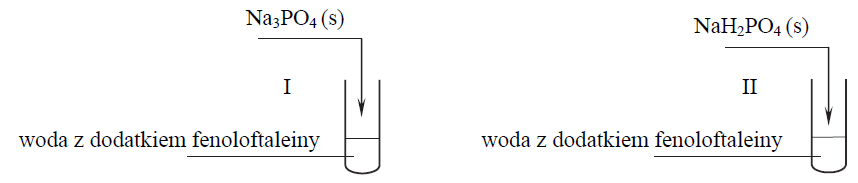
Powstanie malinowego zabarwienia roztworu zaobserwowano tylko w jednej probówce, a pH wodnego roztworu w probówce, w której nie uzyskano malinowego roztworu, było mniejsze od 7.
Napisz w formie jonowej równanie procesu decydującego o odczynie wodnego roztworu tej soli, po której wprowadzeniu do probówki z wodą i fenoloftaleiną nie uzyskano malinowego roztworu.
Wskazanie jonu mogącego pełnić rolę kwasu i zasady Brønsteda wraz z uzasadnieniem równaniami reakcji. Zadanie 18. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
Przeprowadzono doświadczenie zilustrowane poniższym schematem.

Powstanie malinowego zabarwienia roztworu zaobserwowano tylko w jednej probówce, a pH wodnego roztworu w probówce, w której nie uzyskano malinowego roztworu, było mniejsze od 7.
Z dwóch jonów: PO43– i H2PO4–, tylko jeden może pełnić zarówno funkcję zasady Brønsteda, jak i funkcję kwasu Brønsteda.
Wybierz ten jon. Uzupełnij podane poniżej zapisy, tak aby otrzymać dwa równania reakcji (w środowisku kwasowym i zasadowym) z udziałem wybranego jonu.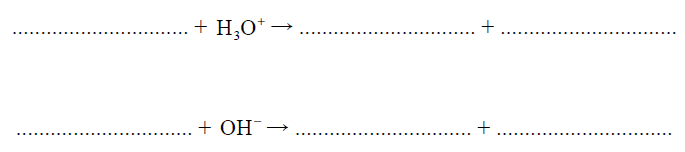
Wybór odczynnika, którego wprowadzenie do roztworu spowoduje usunięcie największej liczby jonów srebrowych. Zadanie 19. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
Iloczyn rozpuszczalności Ks soli i wodorotlenków jest stałą równowagi dynamicznej, jaka ustala się między nasyconym roztworem substancji a jej osadem. W poniższej tabeli zestawiono wartości iloczynu rozpuszczalności trzech trudno rozpuszczalnych w wodzie soli srebra w temperaturze 298 K.

Na podstawie: K.-H. Lautenschläger, W. Schröter, A. Wanninger, Nowoczesne kompendium chemii, Warszawa 2007.
W probówce umieszczono 3 cm3 wodnego roztworu azotanu(V) srebra o stężeniu 0,1 mol ⋅dm–3 . Następnie przygotowano trzy odczynniki:
− wodny roztwór chlorku potasu o stężeniu 0,1 mol ⋅dm–3
− wodny roztwór bromku potasu o stężeniu 0,1 mol ⋅dm–3
− wodny roztwór jodku potasu o stężeniu 0,1 mol ⋅dm–3.
Wybierz odczynnik, którego dodanie do roztworu azotanu(V) srebra w ilości stechiometrycznej spowoduje, że stężenie jonów Ag+ w roztworze po reakcji będzie najmniejsze. Uzupełnij schemat doświadczenia – wpisz nazwę wybranego odczynnika. Uzasadnij swój wybór.
Obliczanie masy próbki stanowiącej mieszaninę węglanu i wodorowęglanu wapnia poddaną prażeniu. Zadanie 20. Arkusz CKE chemia maj 2016 rozszerzony (2 punkty)
Do próbki o masie m, która zawierała mieszaninę stałego węglanu wapnia i stałego wodorowęglanu wapnia w stosunku molowym nCaCO3 : nCa(HCO3 )2 = 1 : 2, dodano nadmiar kwasu solnego. W wyniku zachodzących reakcji zebrano 5,6 dm3 tlenku węgla(IV) odmierzonego w warunkach normalnych. Opisane przemiany prowadzące do wydzielenia gazu można zilustrować równaniami:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Ca(HCO3)2 + 2HCl → CaCl2 + 2CO2 + 2H2O
Oblicz masę m opisanej próbki. Przyjmij, że obie reakcje przebiegły z wydajnością równą 100%.
Zapis równania reakcji chemicznej w formie jonowej. Zadanie 21.1. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
W celu zbadania efektu cieplnego reakcji chemicznych przeprowadzono cztery doświadczenia oznaczone numerami I–IV. Mieszano po 100 cm3 wodnych roztworów substancji, wymienionych w odpowiednich wierszach tabeli, o stężeniu molowym 0, 2 mol ⋅dm−3 i o początkowej temperaturze równej 25 oC. Następnie zmierzono temperaturę każdej z otrzymanych mieszanin.
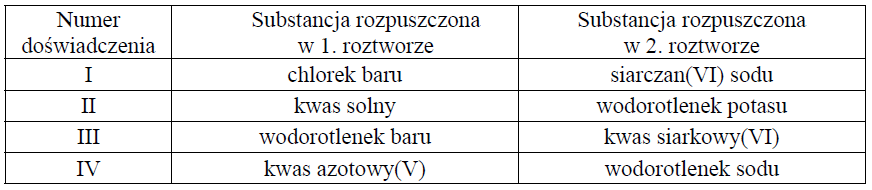
Zaobserwowano, że w każdym doświadczeniu temperatura uzyskanych mieszanin była wyższa niż temperatura użytych roztworów i że przyrost temperatury ΔT w niektórych doświadczeniach był taki sam.
Napisz w formie jonowej równanie reakcji ilustrujące przemiany, które dokonały się podczas doświadczenia oznaczonego numerem III.
Wybór doświadczeń podczas których zaobserwowano jednakowy wzrost temperatury. Zadanie 21.2. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
W celu zbadania efektu cieplnego reakcji chemicznych przeprowadzono cztery doświadczenia oznaczone numerami I–IV. Mieszano po 100 cm3 wodnych roztworów substancji, wymienionych w odpowiednich wierszach tabeli, o stężeniu molowym 0, 2 mol ⋅dm−3 i o początkowej temperaturze równej 25 oC. Następnie zmierzono temperaturę każdej z otrzymanych mieszanin.

Zaobserwowano, że w każdym doświadczeniu temperatura uzyskanych mieszanin była wyższa niż temperatura użytych roztworów i że przyrost temperatury ΔT w niektórych doświadczeniach był taki sam.
Napisz numery wszystkich doświadczeń, w których zaobserwowany wzrost temperatury ΔT był jednakowy.
Wskazanie właściwej blaszki oraz zapis równania reakcji chemicznej. Zadanie 22. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
Przeprowadzono doświadczenie zilustrowane poniższym schematem.
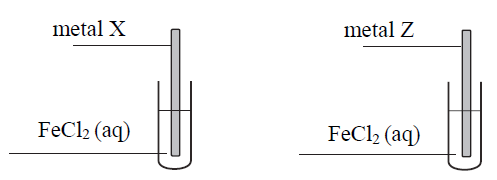
Celem doświadczenia było odróżnienie dwóch, oznaczonych umownie literami X i Z, metali,z których wykonano płytki. Wiadomo, że jednym metalem był cynk, a drugim – nikiel. Po pewnym czasie obie płytki wyjęto z roztworów, osuszono i zważono. Stwierdzono, że zmieniła się tylko masa płytki wykonanej z metalu X.
Uzupełnij poniższe zdania. Wybierz i zaznacz właściwe określenie spośród podanych w każdym nawiasie oraz napisz w formie jonowej skróconej równanie zachodzącej reakcji. Masa płytki wykonanej z metalu X się (zmniejszyła / zwiększyła). Podczas przeprowadzonego doświadczenia przebiegła reakcja zilustrowana równaniem: Metalem Z był (cynk / nikiel).
Ustalanie wzoru sumarycznego alkanu na podstawie ilości produktu uzyskanej w wyniku ciągu reakcji chemicznych. Zadanie 23. Arkusz CKE chemia maj 2016 rozszerzony (2 punkty)
Próbkę 0,86 grama pewnego alkanu poddano całkowitemu spaleniu, a cały otrzymany w tej reakcji tlenek węgla(IV) pochłonięto w wodzie wapiennej, w której zaszła reakcja zgodnie z równaniem:
CO2 + Ca(OH)2 → CaCO3 + H2O
Otrzymany osad ważył po wysuszeniu 6 gramów.
Ustal wzór sumaryczny tego alkanu. W obliczeniach zastosuj wartości masy molowej reagentów zaokrąglone do jedności.
Ustalenie wzorów grupowych alkenów na podstawie reakcji rozszczepienia ich cząsteczek zakwaszonym roztworem manganianu(VII) potasu. Zadanie 24.1. Arkusz CKE chemia maj 2016 rozszerzony (2 punkty)
Do określania położenia podwójnego wiązania w cząsteczkach alkenów wykorzystuje się ich utlenianie, np. za pomocą roztworu KMnO4 w środowisku kwasowym i w podwyższonej temperaturze. W tych warunkach dochodzi do rozerwania wiązania podwójnego węgiel – węgiel. W zależności od budowy cząsteczki alkenu mogą powstać kwasy karboksylowe, ketony lub tlenek węgla(IV).

Na podstawie: R. Morrison, R. Boyd, Chemia organiczna, Warszawa 1985.
Izomeryczne alkeny A i B utleniano KMnO4 w środowisku kwasowym. W wyniku przemiany, której uległ alken A, otrzymano jeden organiczny produkt, natomiast w wyniku utleniania alkenu B powstały dwa związki należące do różnych grup związków organicznych. W reakcji 1 mola alkenu B z 1 molem wodoru powstaje 2-metylopentan. Alken A występuje w postaci izomerów geometrycznych cis–trans.
Napisz wzory półstrukturalne (grupowe) alkenów A i B. Wyjaśnij, dlaczego alken B nie występuje w postaci izomerów geometrycznych cis–trans. Wyjaśnienie:
Zapis nazw systematycznych organicznych produktów rozszczepienia cząsteczek alkenów zakwaszonym roztworem manganianu(VII) potasu. Zadanie 24.2. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
Do określania położenia podwójnego wiązania w cząsteczkach alkenów wykorzystuje się ich utlenianie, np. za pomocą roztworu KMnO4 w środowisku kwasowym i w podwyższonej temperaturze. W tych warunkach dochodzi do rozerwania wiązania podwójnego węgiel – węgiel. W zależności od budowy cząsteczki alkenu mogą powstać kwasy karboksylowe, ketony lub tlenek węgla(IV).

Na podstawie: R. Morrison, R. Boyd, Chemia organiczna, Warszawa 1985.
Izomeryczne alkeny A i B utleniano KMnO4 w środowisku kwasowym. W wyniku przemiany, której uległ alken A, otrzymano jeden organiczny produkt, natomiast w wyniku utleniania alkenu B powstały dwa związki należące do różnych grup związków organicznych. W reakcji 1 mola alkenu B z 1 molem wodoru powstaje 2-metylopentan. Alken A występuje w postaci izomerów geometrycznych cis–trans.
Podaj nazwy wszystkich związków organicznych, które powstały w wyniku utleniania alkenów A i B.
Wybór właściwych wyrazów dotyczących mechanizmu addycji wody do alkenów w środowisku kwasowym. Zadanie 25.1. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
Woda przyłącza się do alkenów w obecności silnie kwasowego katalizatora H3O+. Addycja ta przebiega poprzez tworzenie kationów z ładunkiem dodatnim zlokalizowanym na atomie węgla, czyli tzw. karbokationów. Mechanizm tej reakcji dla alkenów o wzorze ogólnym R–CH=CH2 (R – grupa alkilowa) można przedstawić w trzech etapach.
Uwaga: w poniższych równaniach etapów reakcji wzór wody przedstawiono jako :OH2, a wzór kwasowego katalizatora zapisano jako H:OH2+.
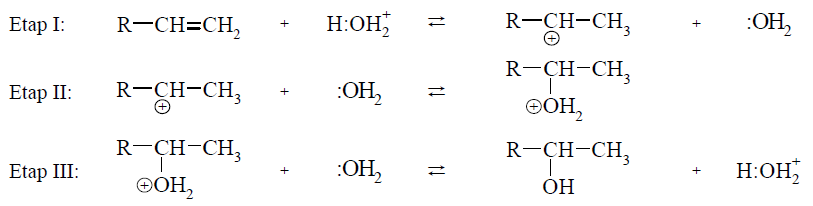
Na podstawie: R. Morrison, R. Boyd, Chemia organiczna, Warszawa 1985.
Uzupełnij poniższe zdania. Wybierz i zaznacz jedno właściwe określenie spośród podanych w każdym nawiasie.
Podczas etapu I alken ulega działaniu reagenta (wolnorodnikowego / nukleofilowego / elektrofilowego). W etapie II karbokation łączy się z cząsteczką wody, w wyniku czego powstaje protonowany alkohol. Na tym etapie przemiany woda działa jako (nukleofil / elektrofil). Podczas etapu III protonowany alkohol (oddaje / pobiera) proton, co prowadzi do powstania obojętnego alkoholu oraz do odtworzenia katalizatora.
Wybór wzorów alkoholi, których nie można otrzymać metodą opisaną w treści wprowadzającej do zadania. Zadanie 25.2. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
Woda przyłącza się do alkenów w obecności silnie kwasowego katalizatora H3O+. Addycja ta przebiega poprzez tworzenie kationów z ładunkiem dodatnim zlokalizowanym na atomie węgla, czyli tzw. karbokationów. Mechanizm tej reakcji dla alkenów o wzorze ogólnym R–CH=CH2 (R – grupa alkilowa) można przedstawić w trzech etapach.
Uwaga: w poniższych równaniach etapów reakcji wzór wody przedstawiono jako :OH2, a wzór kwasowego katalizatora zapisano jako H:OH2+.
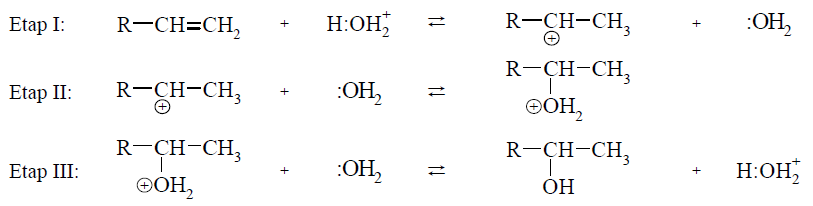
Na podstawie: R. Morrison, R. Boyd, Chemia organiczna, Warszawa 1985.
Spośród alkoholi o podanych niżej wzorach wybierz te, których nie można (jako produktu głównego) otrzymać podczas hydratacji alkenów prowadzonej w obecności kwasu. Podkreśl wzory wybranych alkoholi i uzasadnij swój wybór. CH3CH2OH CH3CH(OH)CH3 CH3CH2CH2OH CH3CH2CH(OH)CH3 CH3CH2CH2CH2OH Uzasadnienie:

