Wskazanie analitu oraz titranta i określenie odczynu roztworu w punkcie równoważnikowym miareczkowania. Zadanie 13. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
Przeprowadzono doświadczenie, podczas którego do 10 cm3 wodnego roztworu wodorotlenku sodu dodawano kroplami wodny roztwór pewnego elektrolitu o stężeniu cm = 0,1 mol · dm–3, mierząc pH mieszaniny reakcyjnej. Przebieg doświadczenia zilustrowano schematem.
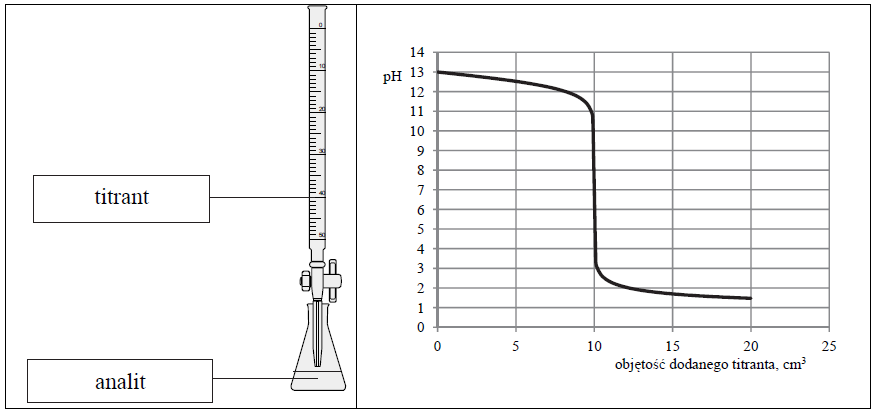
Opisane doświadczenie jest przykładem miareczkowania alkacymetrycznego (kwasowo-zasadowego), które polega na dodawaniu z biurety roztworu, nazywanego titrantem, do kolby z próbką, nazywaną analitem. W miareczkowaniu wykorzystuje się
stechiometryczną zależność między substancjami obecnymi w analicie i titrancie.
Odczytana z wykresu wartość pH roztworu otrzymanego po zmieszaniu roztworów zawierających stechiometryczne ilości reagentów jest równa 7.
Uzupełnij poniższe zdania. Podkreśl właściwy odczyn roztworu, a w miejsca kropek wpisz odpowiednie wzory związków. Można stwierdzić, że otrzymany roztwór, który powstał po zmieszaniu roztworów zawierających stechiometryczne ilości reagentów, miał odczyn Informacje te pozwalają na jednoznaczny wybór spośród wodnych roztworów elektrolitów:
(kwasowy / obojętny / zasadowy) oraz że analitem był wodny roztwór .
HCOOH (aq), CH3COOH (aq), HCl (aq), NH3 (aq), NaOH (aq)
związku, którego wodny roztwór pełnił podczas opisanego doświadczenia funkcję titranta. Związek ten ma wzór .