23.08.2021 | 0 komentarze

Reakcje równowagowe są procesami, które kończą się stanem równowagi dynamicznej. W stanie takim szybkość reakcji biegnącej w prawą stronę jest dokładnie taka sama jak szybkość reakcji biegnącej w przeciwnym kierunku. W praktyce oznacza to, że mieszanina poreakcyjna zawiera oprócz produktów również nieprzereagowane substraty. Jeśli w procesie takim biorą udział reagenty gazowe, a sumaryczna liczba moli gazowych substratów jest inna niż sumaryczna liczba moli gazowych produktów, na położenie stanu równowagi wpływa zmiana ciśnienia. Rozważmy reakcję syntezy amoniaku:
N2 (g) + 3H2 (g) ⇄ 2NH3 (g)
W powyższym zapisie równania procesu, oznaczenie (g) wskazuje na stan skupienia gazowy danego reagenta w warunkach prowadzonej reakcji. Załóżmy, że opisaną przemianę chemiczną poprowadzimy w temperaturze T, w reaktorze o stałej pojemności, a początkowe liczby moli reagentów będą wynosić – 2 mole azotu (N2) oraz 6 moli wodoru (H2), co oznacza, że substraty zmieszane będą w stosunku stechiometrycznym 1:3, jaki wynika z równania reakcji chemicznej. W opisanych warunkach prowadzenia procesu wydajność tworzenia amoniaku może wynieść 50%. Skoro substraty zmieszane zostały w stosunku stechiometrycznym, to stopień przereagowania każdego z nich równy jest wydajności reakcji chemicznej, zatem z dwóch moli dostępnego azotu (N2) reaguje 1 mol i jednocześnie z sześciu moli wodoru (H2) reagują 3 mole. W rezultacie powstają 2 mole amoniaku (NH3).
Spróbujmy teraz odpowiedzieć na pytanie: czy w momencie osiągnięcia przez układ stanu równowagi dynamicznej, ciśnienie panujące w reaktorze było wyższe, czy może niższe niż w momencie zainicjowania reakcji, w tej samej temperaturze T.
W celu zrozumienia tego, co dzieje się w reaktorze posłużymy się modelem jakim jest winda, którą podróżują nasze reagenty. Jak widzimy na poniższym rysunku, na parterze do windy wsiadły substraty:
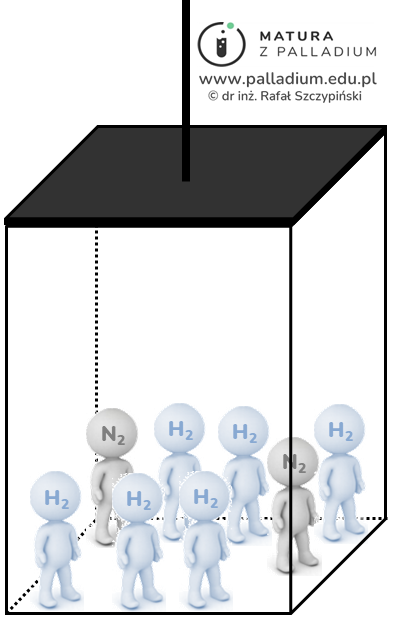
W momencie, gdy inicjujemy jazdę windą w temperaturze T (rozpoczynamy reakcję chemiczną), w windzie znajdują się 2 mole N2 oraz 6 moli H2.
Winda porusza się i na kolejnych piętrach wysiadają z niej cząsteczki substratów – azotu (1 mol) oraz wodoru (3 mole), a wsiadają cząsteczki produktu – amoniaku (2 mole), co można zobrazować schematem:
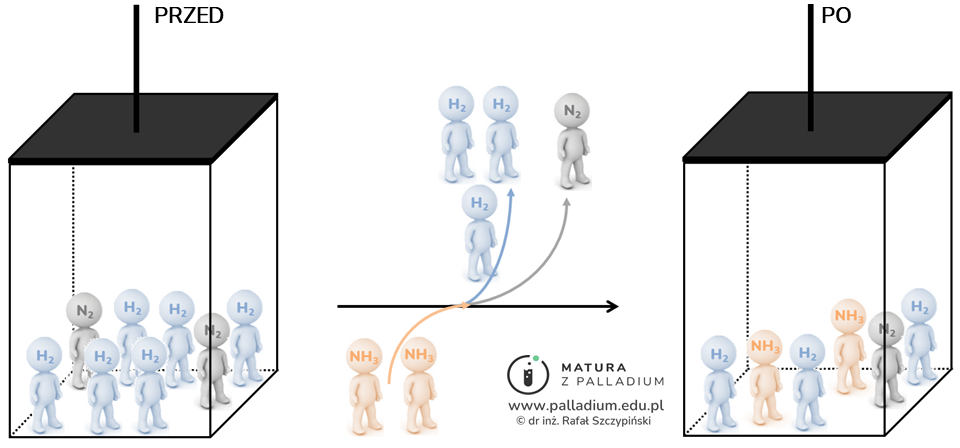
Możemy teraz odpowiedzieć na postawione pytanie dotyczące ciśnienia panującego w reaktorze. W momencie rozpoczęcia reakcji chemicznej (jazdy windą) cząsteczki były bardziej „upchane” (było ich 8 moli), niż w momencie osiągnięcia stanu równowagi (6 moli). Oznacza to, że w wyniku zachodzącego procesu ciśnienie spadło, ponieważ przestrzeń reakcyjna w fazie gazowej zawiera wówczas mniejszą liczbę cząsteczek.
Możemy teraz sformułować wniosek.
Jeśli z równania reakcji wynika, że sumaryczna liczba moli gazowych substratów jest większa niż sumaryczna liczba moli gazowych produktów, to w tej samej temperaturze po zakończeniu reakcji chemicznej ciśnienie panujące w reaktorze będzie niższe, niż w momencie jej rozpoczęcia.
A w innym przypadku…
Jeśli z równania reakcji wynika, że sumaryczna liczba moli gazowych substratów jest mniejsza niż sumaryczna liczba moli gazowych produktów, to w tej samej temperaturze po zakończeniu reakcji chemicznej ciśnienie panujące w reaktorze będzie wyższe, niż w momencie jej rozpoczęcia.
Na koniec warto wspomnieć, że zadanie związane z tym zagadnieniem pojawiło się już na maturze: zadanie 15, maj 2018.
Wykład dotyczący procesów równowagowych znajdziesz tutaj, a związane z nim zadania znajdują się w tym miejscu.
Spodobał Ci się ten artykuł? Polub mój fanpage na Facebooku oraz na Instagramie, aby nie ominęły Cię żadne nowości.
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone