Jedną z technik analitycznych jest metoda emisyjnej spektroskopii atomowej, która polega na badaniu charakterystycznego promieniowania emitowanego przez atomy pierwiastków po ich wzbudzeniu w odpowiedniej temperaturze. Na przykład, po umieszczeniu drucika platynowego na którym znajduje się wodny roztwór soli można zaobserwować zmianę barwy płomienia, w zależności od kationu wchodzącego w skład badanego roztworu:
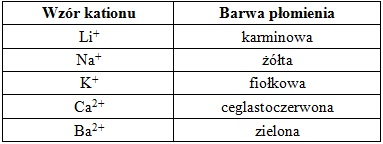
Na podstawie: J. Minczewski, Z. Marczenko, Chemia analityczna. Podstawy teoretyczne i analiza jakościowa, Warszawa 2012.
W sześciu kolbach o numerach 1–6, losowo znajdowały się wodne roztwory soli o wzorach:
AgNO3, K2SO4, BaCl2, K2SO3, Cr2(SO4)3, LiNO3.
W celu identyfikacji zawartości naczyń przeprowadzono dwuetapowe doświadczenie chemiczne, przy czym w żadnym z jego etapów nie wykorzystano roztworu z kolby oznaczonej numerem 3.
Etap I: z pięciu kolb pobrano próbki roztworów o objętości 1 cm3 i umieszczono w osobnych probówkach. Do każdej z nich wprowadzono następnie roztwór kwasu solnego. Z probówki nr 4 wydzielił się bezbarwny gaz o drażniącej woni, a w probówce oznaczonej cyfrą 5 strącił się osad, który pociemniał na świetle. W probówkach o numerach 1, 2 oraz 6 nie zaobserwowano żadnych zmian.
Etap II: z kolb oznaczonych numerami 1, 2 oraz 6 pobrano próbki roztworów i na druciku platynowym kolejno umieszczano je w płomieniu palnika gazowego. Płomień zmienił wówczas barwę na kolor karminowy, fiołkowy oraz zielony.
Z kolby oznaczonej numerem 3 pobrano 1 cm3 roztworu i umieszczono w probówce. Do naczynia tego, kroplami wprowadzono następnie roztwór wody amoniakalnej. Zaobserwowano, że początkowo strącił się szarozielony osad, który po wprowadzeniu nadmiarowych porcji wody amoniakalnej uległ roztworzeniu. W ten sposób uzyskano wodny roztwór związku kompleksowego, zawierającego jony złożone o liczbie koordynacyjnej równej 6. W jonach tych rolę ligandów pełnią cząsteczki amoniaku.
Napisz w formie jonowej skróconej równanie reakcji chemicznej prowadzącej do roztworzenia szarozielonego osadu z utworzeniem jonu kompleksowego. Następnie wyjaśnij, dlaczego cząsteczki amoniaku mogą pełnić rolę ligandów w powstałym jonie kompleksowym?
Równanie reakcji:
Wyjaśnienie:
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone