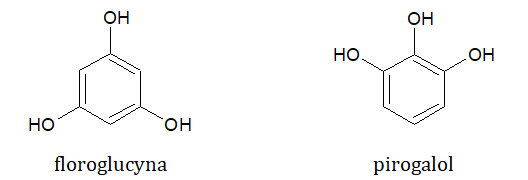Określanie odczynu wodnego roztworu soli amoniowej z uzasadnieniem równaniem reakcji chemicznej
W celu ustalenia struktury cząsteczek dwóch różniących się rzędowością amidów X i Y przeprowadzono szereg eksperymentów z ich udziałem, które schematycznie zilustrowano za pomocą poniższego rysunku:
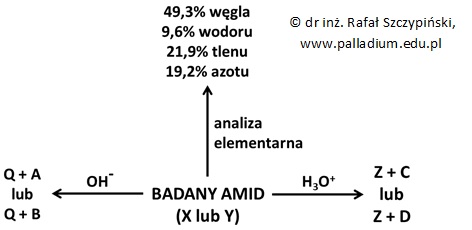
W warunkach normalnych związki A i B są cieczami, a temperatura wrzenia pierwszego z nich jest niższa od temperatury wrzenia drugiego. W temperaturze 25 ⁰C i pod ciśnieniem normalnym oba te związki są gazami, a 4,5 g każdego z nich zajmuje wówczas objętość równą 2,44 dm3. Wiadomo, że związek C jest obok związku Z produktem kwasowej hydrolizy amidu X, a wartość pH jego wodnego roztworu jest większa od wartości pH roztworu związku chemicznego D o takim samym stężeniu molowym. Po dodaniu substancji Z do zakwaszonego roztworu manganianu(VII) potasu wydziela się gaz powodujący zmętnienie wody wapiennej.
Podaj odczyn wodnego roztworu związku chemicznego D. Odpowiedź uzasadnij równaniem odpowiedniej reakcji chemicznej zapisanym w formie jonowej skróconej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone Wskazówka: Film, w którym rozszyfrowano wzory związków A, B C i D przedstawiono w rozwiązaniu do zadania pod tym linkiem: Ustalanie wzoru sumarycznego oraz wzorów półstrukturalnych izomerycznych amidów
Określanie wzoru półstrukturalnego oraz nazwy II-rzędowego amidu izomerycznego z innymi amidami
W celu ustalenia struktury cząsteczek dwóch różniących się rzędowością amidów X i Y przeprowadzono szereg eksperymentów z ich udziałem, które schematycznie zilustrowano za pomocą poniższego rysunku:

W warunkach normalnych związki A i B są cieczami, a temperatura wrzenia pierwszego z nich jest niższa od temperatury wrzenia drugiego. W temperaturze 25 ⁰C i pod ciśnieniem normalnym oba te związki są gazami, a 4,5 g każdego z nich zajmuje wówczas objętość równą 2,44 dm3. Wiadomo, że związek C jest obok związku Z produktem kwasowej hydrolizy amidu X, a wartość pH jego wodnego roztworu jest większa od wartości pH roztworu związku chemicznego D o takim samym stężeniu molowym. Po dodaniu substancji Z do zakwaszonego roztworu manganianu(VII) potasu wydziela się gaz powodujący zmętnienie wody wapiennej.
Istnieje tylko jeden II-rzędowy izomeryczny ze związkami X i Y amid.
Narysuj wzór półstrukturalny jego cząsteczki oraz podaj nazwę systematyczną. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone Wskazówka: Film, w którym rozszyfrowano wzory związków A, B C i D przedstawiono w rozwiązaniu do zadania pod tym linkiem: Ustalanie wzoru sumarycznego oraz wzorów półstrukturalnych izomerycznych amidów
Wyjaśnienie przyczyny najniższej temperatury wrzenia określonej aminy
W tabeli zebrano informacje na temat wartości temperatur wrzenia (1013 hPa) trzech wybranych amin alifatycznych: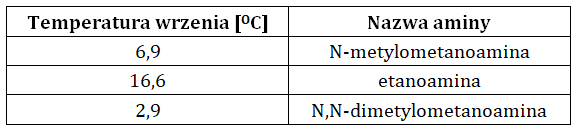
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Wyjaśnij, dlaczego wśród wymienionych amin temperatura wrzenia N,N-dimetylometanoaminy jest najniższa, pomimo największej masy cząsteczkowej tego związku chemicznego? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równania reakcji z udziałem roztworu fenolanu potasu oraz tlenku węgla(IV)
Podczas przepuszczania gazowego tlenku węgla(IV) przez wodny roztwór fenolanu potasu obserwuje się mętnienie zawartości naczynia reakcyjnego. Przyczyną takiego zjawiska jest powstający fenol, który w warunkach prowadzonego doświadczenia niezbyt dobrze rozpuszcza się w wodzie. Drugim produktem reakcji jest słabszy od fenolu anionowy kwas Brønsteda.
Stosując grupowe lub uproszczone wzory związków organicznych napisz w formie jonowej skróconej równanie opisanej przemiany chemicznej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie mocy fenoli jako kwasów na podstawie wartości stałych dysocjacji
W poniższej tabeli zebrano dane na temat stałych dysocjacji trzech związków chemicznych A÷C o nazwach: 2-metylofenol (o-metylofenol), 4-nitrofenol (p-nitrofenol) oraz fenol.
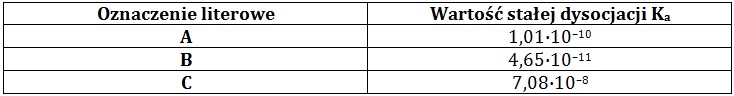
Moc fenoli jako kwasów Brønsteda maleje, gdy w ich cząsteczkach pojawia się ugrupowanie alkilowe.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Przyporządkuj literom A, B i C nazwy podanych związków chemicznych. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie odczynu roztworów fenolanów oraz uszeregowanie ich według wzrastającej wartości pH
W poniższej tabeli zebrano dane na temat stałych dysocjacji trzech związków chemicznych A÷C o nazwach: 2-metylofenol (o-metylofenol), 4-nitrofenol (p-nitrofenol) oraz fenol.

Moc fenoli jako kwasów Brønsteda maleje, gdy w ich cząsteczkach pojawia się ugrupowanie alkilowe.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Określ odczyn 0,1-molowych wodnych roztworów soli potasowych wymienionych związków chemicznych, a następnie uszereguj je zgodnie z rosnącą wartością pH. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Rysowanie wzoru półstrukturalnego cząsteczki imidu oraz określanie liczby wiązań sigma i pi
Przykładem pochodnych kwasów karboksylowych są imidy, w cząsteczkach których atom azotu połączony jest z atomami węgla obu grup karbonylowych.
Narysuj wzór półstrukturalny cząsteczki imidu kwasu benzeno-1,2-dikarboksylowego i określ liczbę znajdujących się w niej wiązań σ oraz wiązań π. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie rozpuszczalności hydratu chlorku żelaza(II) na podstawie stężenia procentowego nasyconego roztworu (rozpuszczalność substancji)
Nasycony w temperaturze 20 oC wodny roztwór chlorku żelaza(II) ma stężenie równe 38,5%.
Oblicz (wyrażoną w g/100 g wody) rozpuszczalność hydratu o wzorze sumarycznym FeCl2∙4H2O użytego do sporządzenia opisanego nasyconego roztworu chlorku żelaza(II). Wynik podaj z dokładnością do całkowitej liczby gramów. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone