Wyjaśnienie różnic w temperaturach wrzenia kwasu karboksylowego i alkoholu względem aldehydu
W tabeli zebrano informacje na temat wybranych jednofunkcyjnych pochodnych alkanów o prostych łańcuchach węglowych. W kolumnie A podano ich masy molowe, a w kolumnie B odpowiadające im temperatury wrzenia (⁰C) pod ciśnieniem 1013 hPa.
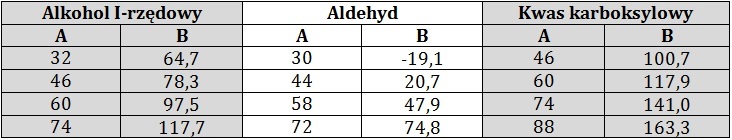
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Podaj przyczynę tak dużych różnic w wartościach temperatur wrzenia alkoholu oraz kwasu karboksylowego, w porównaniu z aldehydem o zbliżonej do nich masie molowej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wyjaśnienie różnic w temperaturach wrzenia kwasu karboksylowego oraz alkoholu
W tabeli zebrano informacje na temat wybranych jednofunkcyjnych pochodnych alkanów o prostych łańcuchach węglowych. W kolumnie A podano ich masy molowe, a w kolumnie B odpowiadające im temperatury wrzenia (⁰C) pod ciśnieniem 1013 hPa.

Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Wyjaśnij, dlaczego temperatura wrzenia kwasu karboksylowego jest wyższa od temperatury wrzenia alkoholu o identycznej masie molowej? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie kolejności zmiany stanu skupienia przez związki organiczne
W tabeli zebrano informacje na temat wybranych jednofunkcyjnych pochodnych alkanów o prostych łańcuchach węglowych. W kolumnie A podano ich masy molowe, a w kolumnie B odpowiadające im temperatury wrzenia (⁰C) pod ciśnieniem 1013 hPa.

Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
W czterech parownicach umieszczono próbki (po 5 ml każda) metanolu, kwasu mrówkowego, propanalu oraz etanolu i ostrożnie ogrzewano na łaźni olejowej.
W jakiej kolejności swój stan skupienia zmienią poszczególne związki chemiczne? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie wzoru sumarycznego hydratu jodku sodu na podstawie jego rozpuszczalności oraz soli bezwodnej
W temperaturze 20 oC wyrażona w g/100 g wody rozpuszczalność pewnego hydratu jodku sodu oraz soli bezwodnej wynoszą odpowiednio 383 g oraz 177,4 g. W tej samej temperaturze nasycone roztwory wodne uzyskane w wyniku rozpuszczenia hydratu lub jego soli bezwodnej charakteryzują się identyczną wartością stężenia procentowego.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013 oraz R. Szczypiński, Projektowanie doświadczeń chemicznych. Dla maturzystów i nie tylko, Warszawa 2019.
Wykonując niezbędne obliczenia ustal wzór sumaryczny opisanego w informacji wprowadzającej hydratu jodku sodu. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie równania kinetycznego reakcji utleniania jonów jodkowych jonami nadtlenodisiarczanowymi
Proces utleniania jonów jodkowych jonami nadtlenodisiarczanowymi przebiega w środowisku wodnym zgodnie z równaniem stechiometrycznym:
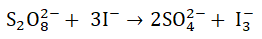
Na podstawie: P. W. Atkins, L. Jones, Chemia ogólna. Cząsteczki, materia, reakcje, Warszawa 2018.
Podczas wyznaczania rzędowości opisanej reakcji chemicznej względem każdego z substratów stwierdzono, że w wyniku dwukrotnego zwiększenia stężenia jonów jodkowych (przy stałym stężeniu jonów S2O82–) szybkość reakcji wzrasta dwukrotnie. Zmniejszając dwukrotnie stężenie jonów S2O82– (przy stałym stężeniu jonów jodkowych) szybkość reakcji utleniania jonów jodkowych dwukrotnie maleje.
Napisz równanie kinetyczne opisanego procesu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wyjaśnienie przyczyny spadku temperatury wrzenia amidów wraz ze wzrostem ich rzędowości
Temperatura wrzenia amidów jest ściśle powiązana z budową ich cząsteczek. Na poniższym diagramie litery A÷F oznaczają pewne amidy różniące się liczbą atomów węgla w cząsteczce oraz rzędowością. Są to w losowej kolejności wymienione związki chemiczne o nazwach: etanoamid, N,N-dimetylometanoamid, N-metyloetanoamid, metanoamid, N,N-dimetyloetanoamid, , N-metylometanoamid.
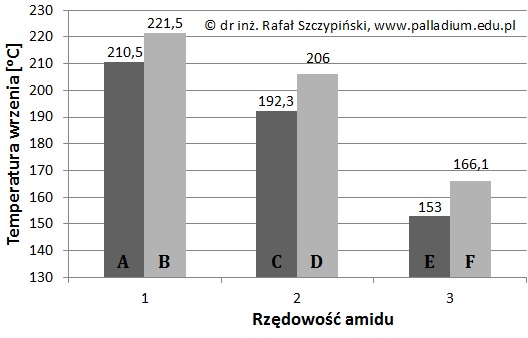
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Wyjaśnij, dlaczego temperatury wrzenia amidów zwykle maleją wraz ze wzrostem ich rzędowości? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wyznaczanie równania kinetycznego reakcji chemicznej na podstawie zmiany stężenia jednego substratu przy stałym stężeniu drugiego
Zbadano wpływ zmiany stężeń początkowych substratów A i B na szybkość pewnej reakcji chemicznej biegnącej według schematu:
3A(g) + 2B(g) → X(g)
Każde z doświadczeń przeprowadzono w temperaturze 400 K. Dane zebrano w tabeli.
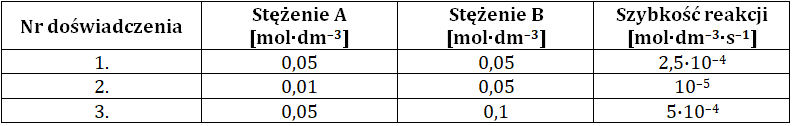
Uwzględniając wartość stałej szybkości opisanej reakcji chemicznej napisz jej równanie kinetyczne oraz określ całkowitą rzędowość. Równanie kinetyczne: …………………………………………..……… Rząd reakcji: …………………. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ustalanie wzoru sumarycznego pochodnej kwasu karboksylowego na podstawie procentu wagowego węgla
Wiadomo, że w dwudodatnich jonach metalicznego pierwiastka Y elektrony opisane są czternastoma orbitalami, przy czym elektrony sparowane – trzynastoma orbitalami. Wodny roztwór pewnego związku chemicznego zawiera wyżej opisane jony pierwiastka Y oraz aniony reszty kwasowej nasyconego kwasu monokarboksylowego. W cząsteczkach tego kwasu atomy węgla stanowią 40% masy.
Wykonaj niezbędne obliczenia, a następnie ustal wzór sumaryczny oraz nazwę systematyczną związku chemicznego, o którego wodnym roztworze mowa. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ustalanie wzorów grupowych cząsteczek dwóch izomerycznych kwasów karboksylowych
W cząsteczkach pewnych kwasów karboksylowych stosunek wagowy pierwiastków (C:H:O) wynosi 9:1:12, przy czym liczba atomów węgla równa jest liczbie atomów tlenu.
Narysuj wzory półstrukturalne cząsteczek opisanych związków chemicznych, wiedząc, że ich wzór rzeczywisty jest taki sam, jak wzór empiryczny, a atomy węgla połączone są wyłącznie wiązaniami typu sigma (σ). © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Rysowanie wzorów półstrukturalnych cząsteczek salicylamidu oraz paracetamolu
Paracetamol oraz salicylamid są amidami o działaniu leczniczym. Pierwszy z wymienionych związków chemicznych jest pochodną 4-hydroksyaniliny i kwasu octowego, drugi natomiast – kwasu salicylowego i amoniaku. Przeprowadzono doświadczenie z wykorzystaniem wodnych zawiesin paracetamolu i salicylamidu oraz sproszkowanego mocznika i węglanu potasu. Po dodaniu do każdej z probówek stechiometrycznej ilości kwasu siarkowego(VI), ich zawartość ogrzewano na łaźni wodnej.
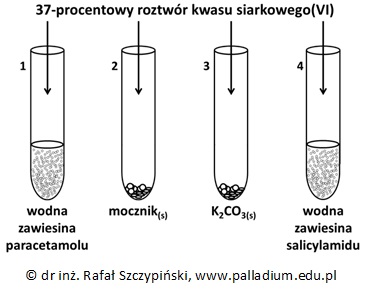
Narysuj półstrukturalne wzory cząsteczek paracetamolu oraz salicylamidu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Opis obserwacji towarzyszących przeprowadzonemu doświadczeniu z udziałem amidów oraz soli
Paracetamol oraz salicylamid są amidami o działaniu leczniczym. Pierwszy z wymienionych związków chemicznych jest pochodną 4-hydroksyaniliny i kwasu octowego, drugi natomiast – kwasu salicylowego i amoniaku. Przeprowadzono doświadczenie z wykorzystaniem wodnych zawiesin paracetamolu i salicylamidu oraz sproszkowanego mocznika i węglanu potasu. Po dodaniu do każdej z probówek stechiometrycznej ilości kwasu siarkowego(VI), ich zawartość ogrzewano na łaźni wodnej.

Określ zmiany jakie zaobserwowano w każdej z probówek podczas prowadzenia opisanego doświadczenia. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równań reakcji chemicznych na podstawie przeprowadzonego eksperymentu z udziałem mocznika i węglanu potasu
Paracetamol oraz salicylamid są amidami o działaniu leczniczym. Pierwszy z wymienionych związków chemicznych jest pochodną 4-hydroksyaniliny i kwasu octowego, drugi natomiast – kwasu salicylowego i amoniaku. Przeprowadzono doświadczenie z wykorzystaniem wodnych zawiesin paracetamolu i salicylamidu oraz sproszkowanego mocznika i węglanu potasu. Po dodaniu do każdej z probówek stechiometrycznej ilości kwasu siarkowego(VI), ich zawartość ogrzewano na łaźni wodnej.

Dla probówek o numerach 2 oraz 3 napisz równania przebiegających w nich reakcji chemicznych. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone

