Określanie odczynu roztworu uzyskanego w punkcie równoważnikowym miareczkowania roztworu jednokarboksylowego kwasu
W kolbie stożkowej zawierającej 100 cm3 wody destylowanej z dodatkiem kilku kropli fenoloftaleiny umieszczono 2,96 g próbki pewnego nasyconego alifatycznego kwasu jednokarboksylowego. Zawartość naczynia wymieszano i uzupełniono wodą destylowaną do objętości 150 cm3, a następnie zmiareczkowano wodnym roztworem wodorotlenku sodu o stężeniu 0,4 mol∙dm-3. Punkt równoważnikowy osiągnięto w momencie wykorzystania 100 cm3 roztworu wodorotlenku.
Określ, jaki odczyn miał uzyskany w punkcie równoważnikowym miareczkowania roztwór? Odpowiedź uzasadnij równaniem reakcji chemicznej zapisanym w formie jonowej skróconej. Skorzystaj ze wzoru ogólnego szeregu homologicznego kwasów, do którego należy związek chemiczny opisany w informacji wprowadzającej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie wzoru sumarycznego kwasu jednokarboksylowego wykorzystując miareczkowanie
W kolbie stożkowej zawierającej 100 cm3 wody destylowanej z dodatkiem kilku kropli fenoloftaleiny umieszczono 2,96 g próbki pewnego nasyconego alifatycznego kwasu jednokarboksylowego. Zawartość naczynia wymieszano i uzupełniono wodą destylowaną do objętości 150 cm3, a następnie zmiareczkowano wodnym roztworem wodorotlenku sodu o stężeniu 0,4 mol∙dm-3. Punkt równoważnikowy osiągnięto w momencie wykorzystania 100 cm3 roztworu wodorotlenku.
Wykonaj niezbędne obliczenia i ustal wzór sumaryczny kwasu, którego wodny roztwór poddano miareczkowaniu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Opis obserwacji towarzyszących przeprowadzonemu doświadczeniu z udziałem acetonu, etanalu i kwasu octowego
W trzech probówkach strącono wodorotlenek miedzi(II), a następnie w każdej z nich, w sposób losowy umieszczono wodne roztwory acetonu, etanalu oraz kwasu octowego. Każdym z naczyń energicznie wstrząśnięto i ogrzewano na łaźni wodnej o temperaturze około 90 ⁰C. Tylko w drugiej probówce zaobserwowano zmiany przed rozpoczęciem ogrzewania. W pierwszym i trzecim naczyniu po zakończeniu doświadczenia odnotowano zmianę barwy znajdującego się w nich osadu – odpowiednio na kolor czarny oraz ceglasty.
Określ, co zaobserwowano w drugiej probówce przed rozpoczęciem ogrzewania jej zawartości? Odpowiedź uzasadnij równaniem reakcji chemicznej, której przebiegowi towarzyszyły takie, a nie inne podane przez Ciebie obserwacje. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równania reakcji chemicznej na podstawie przeprowadzonego eksperymentu z utworzeniem czarnej substancji
W trzech probówkach strącono wodorotlenek miedzi(II), a następnie w każdej z nich, w sposób losowy umieszczono wodne roztwory acetonu, etanalu oraz kwasu octowego. Każdym z naczyń energicznie wstrząśnięto i ogrzewano na łaźni wodnej o temperaturze około 90 ⁰C. Tylko w drugiej probówce zaobserwowano zmiany przed rozpoczęciem ogrzewania. W pierwszym i trzecim naczyniu po zakończeniu doświadczenia odnotowano zmianę barwy znajdującego się w nich osadu – odpowiednio na kolor czarny oraz ceglasty.
Napisz równanie reakcji chemicznej, jaka doprowadziła do powstania czarnej substancji i podaj wzór sumaryczny związku chemicznego wchodzącego w skład ceglastego osadu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Bilansowanie równania reakcji kwasu szczawiowego z zakwaszonym roztworem manganianu(VII) potasu
Plamy pozostałe po manganianie(VII) potasu można wywabić roztworem kwasu szczawiowego z dodatkiem rozcieńczonego kwasu siarkowego(VI).
Napisz w formie jonowej skróconej równanie przebiegającej reakcji chemicznej, jaka prowadzi do usunięcia plam. Współczynniki uzgodnij metodą bilansu jonowo-elektronowego. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie wzorów półstrukturalnych izomerów geometrycznych kwasu karboksylowego (izomeria geometryczna)
W celu całkowitego przereagowania 1 g pewnego jednonienasyconego, monokarboksylowego kwasu alifatycznego zużyto 4 g 10% roztworu wodorotlenku sodu.
Podaj nazwę systematyczną tego kwasu oraz wzory półstrukturalne jego izomerów geometrycznych, jeśli wiadomo, że wszystkie atomy węgla w cząsteczkach tego związku chemicznego leżą na tej samej płaszczyźnie. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Uszeregowanie roztworów kwasów dikarboksylowych według wzrastającego stężenia molowego jonów wodorotlenkowych
Na poniższym schemacie przedstawiono trzy ostatnie etapy cyklu Krebsa, w których udział biorą aniony reszt kwasowych czterech kwasów dikarboksylowych – kolejno: bursztynowego, fumarowego, jabłkowego oraz szczawiooctowego. W procesie tym obecne są również dinukleotydy (flawinoadeninowy oraz nikotynoamidoadeninowy), którym przypisuje się oznaczenia: FAD i FADH2 oraz NAD+ i NADH. Literami A, B oraz C oznaczono pewne przemiany biochemiczne.
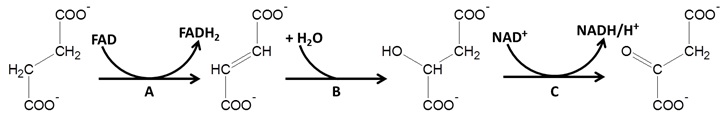
Na podstawie: J. B. Reece i inni, Biologia Campbella, Poznań 2019.
W tabeli zebrano wartości pierwszej stałej dysocjacji kilku kwasów dikarboksylowych.
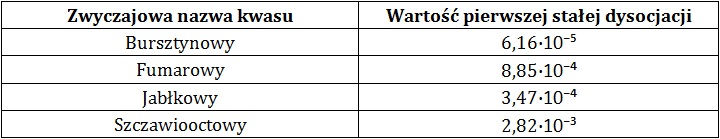
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Sporządzono 0,05-molowe, wodne roztwory wymienionych w informacji wstępnej związków chemicznych.
Uszereguj je zgodnie ze wzrastającym stężeniem jonów wodorotlenkowych. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Odszyfrowanie reagentów ze schematu oraz zapis równań reakcji chemicznych na podstawie informacji wprowadzającej
Przeprowadzono doświadczenie chemiczne zilustrowane schematem:
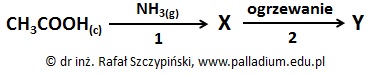
Substancje X oraz Y są związkami organicznymi.
Napisz równania przebiegających reakcji chemicznych, opisanych na schemacie cyframi 1 i 2. Podaj nazwy powstałych związków organicznych X i Y. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone

