Określanie objętości roztworu, jaką należy dodać do nasyconego roztworu zawierającego wspólny jon, aby doszło do zmniejszenia się rozpuszczalności (iloczyn rozpuszczalności)
W temperaturze 25 ⁰C iloczyn rozpuszczalności wodorotlenku magnezu ma wartość 7,94∙10−12, a węglanu wapnia 3,31∙10–9.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Oblicz, jaką objętość 0,05-molowego roztworu wodorotlenku potasu należy dodać do 220 cm3 nasyconego w 25 ⁰C roztworu wodorotlenku magnezu, aby rozpuszczalność Mg(OH)2 zmalała 20-krotnie? Wynik podaj w centymetrach sześciennych, z dokładnością do cyfry jedności. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór poprawnych określeń dotyczących układu zawierającego trudno rozpuszczalny siarczan(VI) wapnia (iloczyn rozpuszczalności)
W temperaturze 25 ⁰C do zlewki zawierającej 250 cm3 wody destylowanej wprowadzono 30 g siarczanu(VI) wapnia, którego iloczyn rozpuszczalności (Kso) w opisanych warunkach ma wartość 3,16∙10–5. Zawartość naczynia zamieszano bagietką i odstawiono na kilka godzin utrzymując podaną wyżej temperaturę. W ten sposób uzyskano układ, którego schemat ilustruje rysunek poniżej. Literami A i B oznaczono pewne jego składniki.
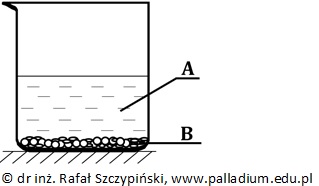
Zakładając, że ubytek wody powstały na skutek jej parowania został uzupełniony do ilości wyjściowej, podkreśl wyrażenia w nawiasach tak, by powstały zdania prawdziwe. W opisanym układzie klarowny roztwór znajdujący się nad osadem siarczanu(VI) wapnia jest roztworem (nienasyconym/nasyconym). Literą A oznaczono substancję (prostą/złożoną), która jest mieszaniną (jednorodną/niejednorodną), natomiast literą B substancję (prostą/złożoną), którą jest związek chemiczny tworzący kryształy (molekularne/jonowe). © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Opis obserwacji towarzyszących przeprowadzonemu doświadczeniu z udziałem wodnej zawiesiny siarczanu(VI) wapnia wraz z uzasadnieniem (iloczyn rozpuszczalności)
W temperaturze 25 ⁰C do zlewki zawierającej 250 cm3 wody destylowanej wprowadzono 30 g siarczanu(VI) wapnia, którego iloczyn rozpuszczalności (Kso) w opisanych warunkach ma wartość 3,16∙10–5. Zawartość naczynia zamieszano bagietką i odstawiono na kilka godzin utrzymując podaną wyżej temperaturę. W ten sposób uzyskano układ, którego schemat ilustruje rysunek poniżej. Literami A i B oznaczono pewne jego składniki.

Opisaną w informacji wprowadzającej zawartość zlewki przesączono. Do przesączu dodano pewną ilość wodnego roztworu chlorku wapnia i zaobserwowano objaw świadczący o przebiegu reakcji chemicznej. Napisz, co zaobserwowano w wyniku przeprowadzonego w temperaturze 25 ⁰C doświadczenia? Odpowiedź uzasadnij równaniem reakcji chemicznej, zapisanym w formie jonowej skróconej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równania odpowiedniej reakcji chemicznej oraz wskazanie nazwy drobiny
W wyniku nasycania wody amoniakiem uzyskuje się roztwór zwany wodą amoniakalną. W celu przygotowania opisanego roztworu, odmierzono pewną objętość amoniaku, a następnie wprowadzono do naczynia zawierającego wodę destylowaną, uzyskując roztwór wody amoniakalnej o stężeniu równym 0,5 mol∙dm–3. Zanurzony w wodzie amoniakalnej żółty papierek wskaźnikowy zmienia swoją barwę.
Napisz w formie jonowej skróconej równanie procesu, w wyniku którego powstają drobiny, jakich obecność przyczynia się do zmiany zabarwienia papierka wskaźnikowego, a następnie podaj nazwę tych drobin. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie minimalnej wartości pH roztworu sprzyjającej strąceniu osadu wodorotlenku wapnia (iloczyn rozpuszczalności)
W pewnej temperaturze rozpuszczalność wodorotlenku wapnia wynosi około 90 mg na 100 g wody.
Oblicz, przy jakiej minimalnej wartości pH w opisanych warunkach strąca się osad tego wodorotlenku? Wynik podaj z dokładnością do trzech cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określenie nazwy systematycznej głównego organicznego produktu reakcji monobromowania kwasu p-aminobenzoesowego
Jednym ze składników kremów do opalania jest związek chemiczny o nazwie kwas p-aminobenzoesowy, którego wzór cząsteczki ilustruje znajdujący się poniżej rysunek. W obecności katalizatora (FeBr3) związek ten może reagować z bromem, a głównym organicznym produktem opisanej przemiany jest taka monobromopochodna kwasu, która powstaje w wyniku sumarycznego działania efektu kierującego nowy podstawnik przez grupę karboksylową oraz aminową.
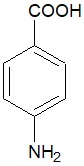
Podaj nazwę systematyczną opisanej monobromopochodnej stanowiącej główny produkt reakcji bromowania kwasu p-aminobenzoesowego w obecności katalizatora. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
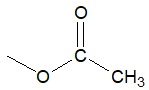
Zapis równania dysocjacji elektrolitycznej kwasu acetylosalicylowego
Kwas acetylosalicylowy jest trudno rozpuszczalnym w wodzie związkiem chemicznym oraz słabym elektrolitem. W temperaturze 25 oC jego rozpuszczalność wynosi 460 mg/100 g wody, a stała równowagi dysocjacji kwasowej ma wartość 3,2·10–4.
Na podstawie: karta charakterystyki preparatu niebezpiecznego, www.sigmaaldrich.com
Napisz zgodnie z teorią Brønsteda-Lowry’ego równanie procesu dysocjacji elektrolitycznej kwasu acetylosalicylowego. Cząsteczkę kwasu oraz anion acetylosalicylanowy zapisz stosując grupowe wzory związków organicznych. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Przypisywanie określonych kwasów (acetylosalicylowego, octowego, mrówkowego) do probówek
W trzech nieoznakowanych probówkach losowo umieszczono wodne roztwory kwasów: acetylosalicylowego, octowego oraz mrówkowego. Przeprowadzono dwie serie doświadczeń z udziałem podanych substancji chemicznych.
1. W wyniku działania zakwaszonym roztworem dwuchromianu(VI) potasu zmianę barwy roztworu zaobserwowano w drugiej probówce.
2. Zawartość każdej z probówek odparowano do sucha. Tylko w pierwszym z naczyń zaobserwowano pojawienie się białego osadu.
Przyporządkuj probówkom 1÷3 nazwy organicznych związków chemicznych, których wodne roztwory poddano opisanym doświadczeniom. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równania reakcji chemicznej oraz obserwacji towarzyszących jej przebiegowi z udziałem kwasu karboksylowego
W trzech nieoznakowanych probówkach losowo umieszczono wodne roztwory kwasów: acetylosalicylowego, octowego oraz mrówkowego. Przeprowadzono dwie serie doświadczeń z udziałem podanych substancji chemicznych.
1. W wyniku działania zakwaszonym roztworem dwuchromianu(VI) potasu zmianę barwy roztworu zaobserwowano w drugiej probówce.
2. Zawartość każdej z probówek odparowano do sucha. Tylko w pierwszym z naczyń zaobserwowano pojawienie się białego osadu.
Napisz w formie jonowej skróconej równanie reakcji chemicznej, jaka przebiegła w drugiej probówce oraz drugi towarzyszący jej objaw i barwę roztworu po reakcji. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone