Obliczanie wartości pH roztworu etyloaminy poddanego miareczkowaniu (miareczkowanie)
Miareczkowano wodny roztwór etanoaminy zawierający 150 mg tej substancji chemicznej. Jako titrant zastosowano 0,1-molowy roztwór kwasu solnego. Punkt równoważnikowy osiągnięto, gdy objętość zmiareczkowanego roztworu była równa 250 cm3.
Pomijając zjawisko kontrakcji, oblicz wartość pH roztworu etanoaminy poddanego miareczkowaniu. Wynik podaj z dokładnością do trzech cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie przyczyny różnic w temperaturach wrzenia wybranych amin
Poniżej przedstawiono wzory cząsteczek czterech amin (A÷D) o prostych łańcuchach węglowych:
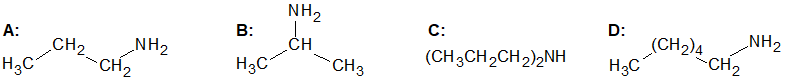
Pomiędzy oznaczeniami literowymi (A÷D) amin wpisz znak „>” lub „<”, opisujący relacje między wartościami ich temperatur wrzenia. Uzasadnij swoje stanowisko. A ………… B C ………… D © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wyjaśnienie przyczyny klasyfikacji dwóch związków organicznych do amin III-rzędowych
Aktywatorami sieciowania nienasyconych żywic poliestrowych mogą być III-rzędowe aminy aromatyczne – na przykład N,N-dimetyloanilina lub N,N-dimetylo-4-metyloanilina.
Na podstawie: G. Rokicki (red.), Ćwiczenia laboratoryjne z chemii związków wielkocząsteczkowych, Warszawa 2001.
Wyjaśnij, dlaczego wymienione związki chemiczne zalicza się do amin III-rzędowych? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Rysowanie wzorów cząsteczek dwóch III-rzędowych amin aromatycznych
Aktywatorami sieciowania nienasyconych żywic poliestrowych mogą być III-rzędowe aminy aromatyczne – na przykład N,N-dimetyloanilina lub N,N-dimetylo-4-metyloanilina.
Na podstawie: G. Rokicki (red.), Ćwiczenia laboratoryjne z chemii związków wielkocząsteczkowych, Warszawa 2001.
Narysuj wzory półstrukturalne (grupowe) cząsteczek wymienionych w informacji wprowadzającej amin. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór poprawnych określeń w nawiasach dotyczących struktury cząsteczek dwóch III-rzędowych amin aromatycznych
Aktywatorami sieciowania nienasyconych żywic poliestrowych mogą być III-rzędowe aminy aromatyczne – na przykład N,N-dimetyloanilina lub N,N-dimetylo-4-metyloanilina.
Na podstawie: G. Rokicki (red.), Ćwiczenia laboratoryjne z chemii związków wielkocząsteczkowych, Warszawa 2001.
Przeanalizuj budowę cząsteczek amin opisanych w informacji wprowadzającej, a następnie podkreśl wyrażenia w nawiasach tak, aby powstały zdania prawdziwe. Wymienione aminy są względem siebie (izomerami/homologami), co oznacza, że ich cząsteczki (różnią/nie różnią) się procentową zawartością azotu. W obu cząsteczkach liczba atomów węgla leżących na tej samej płaszczyźnie jest (taka sama/różna), ponadto mają (taką samą/różną) liczbę atomów węgla, których orbitalom walencyjnym przypisuje się model hybrydyzacji sp2. Orbitalom walencyjnym atomu azotu każdej z wymienionych amin przypisuje się hybrydyzację typu (sp/sp2/sp3). © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie procentowego składu wagowego stopu magnezu z glinem
Na 9 g próbki stopu magnezu z glinem podziałano nadmiarem kwasu solnego. W wyniku przebiegających reakcji chemicznych wydzieliło się 10,64 dm3 wodoru (warunki normalne).
Oblicz procentowy skład wagowy stopu poddanego analizie. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie procentowego składu wagowego mieszaniny soli miedzi(II) na drodze reakcji strąceniowej
Próbkę o masie 10,82 g bezwodnych soli miedzi(II) – siarczanu(VI) oraz azotanu(V) rozpuszczono w wodzie destylowanej. Do powstałego układu wprowadzono roztwór zasady potasowej. Zaobserwowano strącenie się niebieskiego, galaretowatego ciała stałego oraz odbarwienie roztworu. Uzyskaną zawiesinę ogrzano, a następnie powstałe czarne ciało stałe przesączono, przemyto, wysuszono i zważono. Jego masa była równa 4,68 g.
Wiedząc, że wydajność procesu sączenia wyniosła 90%, ustal na podstawie niezbędnych obliczeń procentowy skład wagowy mieszaniny soli przed rozpuszczeniem jej w wodzie destylowanej. Wyniki podaj z dokładnością do trzech cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie objętości powstałego dwutlenku węgla w reakcji kwasu bromowodorowego z zanieczyszczonym węglanem wapnia
Próbkę o masie 7,31 g stanowiącą węglan wapnia zanieczyszczony wodorowęglanem wapnia poddano działaniu nadmiaru kwasu bromowodorowego. W układzie przebiegły wówczas reakcje chemiczne opisane równaniami:
CaCO3 + 2HBr ⟶ CaBr2 + H2O + CO2
Ca(HCO3)2 + 2HBr ⟶ CaBr2 + 2H2O + 2CO2
Po zakończeniu wydzielania się pęcherzyków gazu wodę odparowano, a zawartość naczynia wyprażono do stałej masy, uzyskując w ten sposób 14 g bromku wapnia.
Wiedząc, że objętość molowa gazu w temperaturze 19 oC pod ciśnieniem normalnym wynosi 24 dm3, oblicz, jaką objętość w opisanych warunkach zajmuje powstały tlenek węgla(IV)? Wynik podaj w dm3 z dokładnością do dwóch cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie procentowego składu wagowego brązu na podstawie udziałów procentowych tlenków metali
Brązy to stopy miedzi z cyną. Redukcji poddano mieszaninę tlenków – SnO oraz CuO, w której procent wagowy tlenku miedzi(II) wynosił 91,8%.
Na podstawie niezbędnych obliczeń ustal procentowy skład wagowy uzyskanego w ten sposób brązu. Wynik podaj z dokładnością do cyfry jedności. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ustalanie składu procentowego stopu uzyskanego w wyniku redukcji tlenków metali
Korund to minerał, którego głównym składnikiem jest tlenek glinu. Substancja ta może zawierać również domieszki innych związków chemicznych, na przykład – tlenku tytanu(IV).
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
W wyniku redukcji wodorem próbki korundu o masie 19 g, uzyskano 18 dm3 pary wodnej (394 K, 1000 hPa).
Ustal procentowy skład wagowy uzyskanego stopu glinu z tytanem. Wyniki obliczeń podaj z dokładnością do czterech cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stosunku molowego tlenków ołowiu w mieszaninie użytej do redukcji wodorem
W wyniku redukcji 11,47 g mieszaniny tlenków PbO i PbO2 wodorem uzyskano 1,26 cm3 wody (warunki normalne). Podczas opisanego eksperymentu przebiegły reakcje chemiczne:
PbO + H2 → Pb + H2O
PbO2 + 2H2 → Pb + 2H2O
Oblicz, w jakim stosunku molowym zmieszane były tlenki przed wykonaniem doświadczenia? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równania reakcji chemicznej aminy z kwasem bromowodorowym oraz nazwy powstałego produktu
W celu ustalenia struktury cząsteczek dwóch różniących się rzędowością amidów X i Y przeprowadzono szereg eksperymentów z ich udziałem, które schematycznie zilustrowano za pomocą poniższego rysunku:
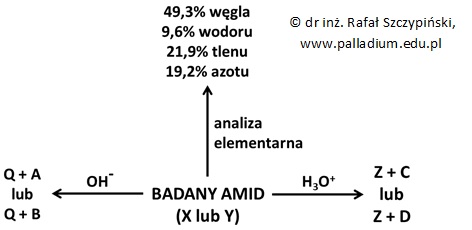
W warunkach normalnych związki A i B są cieczami, a temperatura wrzenia pierwszego z nich jest niższa od temperatury wrzenia drugiego. W temperaturze 25 ⁰C i pod ciśnieniem normalnym oba te związki są gazami, a 4,5 g każdego z nich zajmuje wówczas objętość równą 2,44 dm3. Wiadomo, że związek C jest obok związku Z produktem kwasowej hydrolizy amidu X, a wartość pH jego wodnego roztworu jest większa od wartości pH roztworu związku chemicznego D o takim samym stężeniu molowym. Po dodaniu substancji Z do zakwaszonego roztworu manganianu(VII) potasu wydziela się gaz powodujący zmętnienie wody wapiennej.
Na próbkę związku A podziałano wodnym roztworem bromowodoru i uzyskano związek C.
Wykorzystując półstrukturalne wzory związków organicznych, napisz równanie przebiegającej reakcji chemicznej oraz podaj nazwę jej produktu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone Wskazówka: Film, w którym rozszyfrowano wzory związków A, B C i D przedstawiono w rozwiązaniu do zadania pod tym linkiem: Ustalanie wzoru sumarycznego oraz wzorów półstrukturalnych izomerycznych amidów

