Obliczanie stężenia procentowego glukozy w roztworze z jedną dawką leku Gastrolit
Gastrolit® jest lekiem stosowanym w celu zapobiegania oraz leczeniu odwodnienia w przebiegu biegunek. Jedna dawka Gastrolitu® stanowi mieszaninę zawierającą 350 mg chlorku sodu, 300 mg chlorku potasu, 500 mg wodorowęglanu sodu, 2,98 g glukozy oraz 20 mg rozpuszczalnego w wodzie wyciągu z rumianku, niezawierającego związków jonowych.
Na podstawie: ulotka leku Gastrolit®, Teva Pharmaceuticals Polska Sp. z o.o.
Oblicz stężenie procentowe glukozy w roztworze uzyskanym po rozpuszczeniu jednej dawki leku Gastrolit® w 300 g wody destylowanej. Wynik podaj z dokładnością do drugiego miejsca po przecinku. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stężenia molowego jonów chlorkowych w roztworze z jedną dawką leku Gastrolit
Gastrolit® jest lekiem stosowanym w celu zapobiegania oraz leczeniu odwodnienia w przebiegu biegunek. Jedna dawka Gastrolitu® stanowi mieszaninę zawierającą 350 mg chlorku sodu, 300 mg chlorku potasu, 500 mg wodorowęglanu sodu, 2,98 g glukozy oraz 20 mg rozpuszczalnego w wodzie wyciągu z rumianku, niezawierającego związków jonowych.
Na podstawie: ulotka leku Gastrolit®, Teva Pharmaceuticals Polska Sp. z o.o.
Jedną dawkę leku Gastrolit® rozpuszczono w 250 ml wody destylowanej.
Oblicz stężenie molowe jonów chlorkowych znajdujących się w 200 ml roztworu, jeśli do jego sporządzenia wykorzystano jedną dawkę leku Gastrolit®. Wynik obliczeń podaj w mmol·dm–3, z dokładnością do cyfry jedności. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
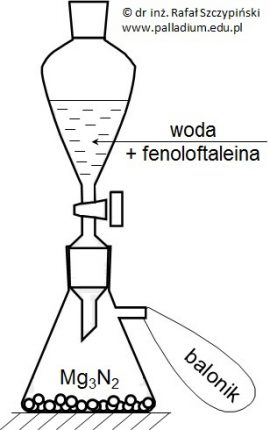
Obliczanie sumarycznej objętości produktów powstałych podczas dwóch etapów doświadczenia
Tak zwany antymon metaliczny otrzymuje się w dwuetapowym procesie reakcyjnym, z wyjściowego surowca, jakim jest siarczek antymonu(III) – antymonit:
Sb2S3 + 5O2 → Sb2O4 + 3SO2 (etap I)
Sb2O4 + 4C → 2Sb + 4CO (etap II)
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Oblicz sumaryczną objętość gazowych produktów (warunki normalne), jakie uzyskano w wyniku przebiegu tego procesu, jeśli wykorzystano 7,64 g rudy zawierającej 11% zanieczyszczeń, które w opisanych warunkach nie wchodzą w reakcję chemiczną. Wynik obliczeń zaokrąglij do drugiego miejsca po przecinku. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stężenia masowego kationów w wodnym roztworze soli sodowej fluoresceiny
Stężenie masowe definiuje się jako masę substancji rozpuszczonej, jaka przypada na określoną jednostkę objętości roztworu.
Na podstawie: D. Mickiewicz, Podstawy obliczeń chemicznych. Część pierwsza, Łódź 2019.
Przez kanalik układu mikroprzepływowego przepływa wodny roztwór soli sodowej fluoresceiny (M = 376 g/mol) o stężeniu masowym równym 0,001 mg∙ml-1. Schemat struktury opisanego związku chemicznego przedstawia rysunek poniżej.
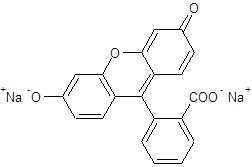
Oblicz stężenie kationów sodu w roztworze opisanym w informacji wprowadzającej. Wynik podaj w ng∙ml-1 (nanogramach na mililitr) z dokładnością do cyfry jedności. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stężenia molowego kationów w wodnym roztworze soli sodowej fluoresceiny
Stężenie masowe definiuje się jako masę substancji rozpuszczonej, jaka przypada na określoną jednostkę objętości roztworu.
Na podstawie: D. Mickiewicz, Podstawy obliczeń chemicznych. Część pierwsza, Łódź 2019.
Przez kanalik układu mikroprzepływowego przepływa wodny roztwór soli sodowej fluoresceiny (M = 376 g/mol) o stężeniu masowym równym 0,001 mg∙ml-1. Schemat struktury opisanego związku chemicznego przedstawia rysunek poniżej.

Oblicz stężenie molowe kationów sodu w roztworze opisanym w informacji wprowadzającej. Wynik podaj w μmol∙dm-3 (mikromolach na decymetr sześcienny) z dokładnością do trzech cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie masy roztworu sacharydu zawierającego taką samą ilość cukru co roztwór o innym stężeniu
Rysunek poniżej przedstawia wzory chemiczne cząsteczek laktozy oraz celobiozy:
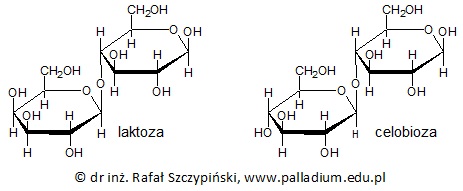
Zawartość laktozy w mleku krowim stanowi około 4,6% jego masy, natomiast w mleku karmiących matek 7%.
Oblicz masę mleka krowiego, w jakiej zawarta jest taka sama ilość laktozy, co w 75 g mleka karmiących matek. Wynik podaj z dokładnością do cyfry jedności. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone