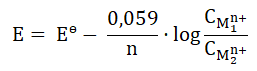Zapis sumarycznego równania reakcji przebiegającej w ogniwie chemicznym zbudowanym z półogniw redoks
Zbudowano ogniwo chemiczne z następujących półogniw redoks:
Fe3+ + ē ⇄ Fe2+ Eo = +0,771 V
MnO4– + 8H+ + 5ē ⇄ Mn2+ + 4H2O Eo = +1,503 V
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Napisz sumaryczne równanie reakcji chemicznej przebiegającej podczas pracy tego ogniwa oraz oblicz jego SEM w stanie standardowym. Równanie reakcji: SEM: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór jonu będącego najsilniejszym utleniaczem oraz zapis barwy roztworu
Zbudowano ogniwo chemiczne z następujących półogniw redoks:
Fe3+ + ē ⇄ Fe2+ Eo = +0,771 V
MnO4– + 8H+ + 5ē ⇄ Mn2+ + 4H2O Eo = +1,503 V
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Spośród jonów potencjałotwórczych znajdujących się w opisanym ogniwie chemicznym wybierz i napisz wzór sumaryczny tego, który jest najsilniejszym utleniaczem. Określ barwę roztworu związku chemicznego zawierającego wybrany przez Ciebie jon, jeśli w układzie nie będzie obecna żadna inna drobina nadająca zabarwienie. Wzór jonu: Barwa roztworu: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie potencjału redoks półogniwa dla różnych stężeń molowych jonów potencjałotwórczych
Wartość potencjału redoks półogniwa Pt|Fe2+, Fe3+ zależy od stężenia molowego każdego z jonów (Fe2+ oraz Fe3+) i w temperaturze 25 oC wyraża się zależnością zwaną równaniem Nernsta w postaci:
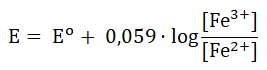
W wyrażeniu tym Eo to standardowy potencjał redoks półogniwa o wartości 0,771 V, natomiast [Fe3+] oraz [Fe2+] są stężeniami molowymi jonów potencjałotwórczych.
W temperaturze 25 oC zbudowano ogniwo chemiczne z dwóch półogniw Pt|Fe2+, Fe3+. W pierwszym z nich stężenie jonów Fe3+ było takie samo jak stężenie jonów Fe2+ w drugim półogniwie i wynosiło 0,5 mol·dm–3. Stężenia pozostałych jonów potencjałotwórczych w tych półogniwach odpowiadały stężeniu jonów chlorkowych w roztworze HCl o pH = 2.
Oblicz SEM opisanego ogniwa chemicznego w temperaturze 25 oC. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stałej równowagi reakcji przebiegającej w ogniwie cynkowo-kadmowym
W stanie równowagi (gdy ogniwo chemiczne uległo wyczerpaniu) standardową siłę elektromotoryczną ogniwa w temperaturze 298 K opisuje wyrażenie:
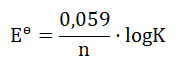
Wielkość K to stała równowagi reakcji redoks przebiegającej podczas pracy ogniwa, natomiast n to liczba moli elektronów wymienionych między utleniaczem i reduktorem.
Na podstawie: K.-H. Lautenschläger i inni, Nowoczesne kompendium chemii, Warszawa 2018.
Oblicz stałą równowagi reakcji w temperaturze 298 K, przebiegającej w pracującym ogniwie zbudowanym z półogniw – cynkowego oraz kadmowego. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ocena poprawności zdań dotyczących doświadczenia z udziałem roztworu wodorotlenku potasu i kwasu siarkowego(VI)
Do 27 g wody destylowanej dodano 6 g tlenku potasu i uzupełniono wodą do objętości 150 cm3. Z uzyskanego w ten sposób roztworu pobrano 20 cm3 próbki za pomocą której zobojętniono 40 cm3 roztworu kwasu siarkowego(VI).
Oceń poprawność poniższych zdań wpisując literę „P” (prawda) lub literę „F” (fałsz). 1. Podczas rozcieńczania do objętości 150 cm3 roztworu zawierającego produkt reakcji tlenku potasu z wodą wartość pH roztworu maleje. 2. Próbka roztworu o objętości 20 cm3 pobrana z roztworu o objętości 150 cm3 ma niższą od tego roztworu wartość pH. 3. Produkt reakcji zobojętniania jest solą pochodzącą od dwuprotonowego słabego kwasu i dlatego ulega on hydrolizie kationowej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór poprawnej kolejności wodnych roztworów w zależności od stężenia jonów wodorowych
W pięciu kolbach miarowych (250 cm3 każda) umieszczono 0,5-molowe, wodne roztwory następujących związków chemicznych:
1) NaOH 2) HCOOH 3) HCl 4) H2SO4 5) NH3
Uszereguj wymienione roztwory według wzrastającego stężenia jonów wodorowych. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stężenia procentowego roztworu po dodaniu dodatkowej porcji glukozy
Do 150 gramów 10-procentowego wodnego roztworu glukozy wprowadzono porcję tego cukru o masie 30 g i całkowicie rozpuszczono.
Oblicz stężenie procentowe uzyskanego roztworu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie masy roztworu przed dodaniem dodatkowej porcji chlorku potasu
W wodnym roztworze chlorku potasu o stężeniu równym 10% rozpuszczono próbkę tej soli zawierającą 0.2 mola jonów potasu, uzyskując w ten sposób roztwór o stężeniu 15%.
Oblicz masę wyjściowego roztworu chlorku potasu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie dodatkowej masy azotanu(V) srebra jaką należy wprowadzić do roztworu tej soli
W laboratorium dysponowano 280 gramami 20-procentowego wodnego roztworu azotanu(V) srebra.
Oblicz, jaką masę tej soli należy wprowadzić do podanego roztworu, aby po jej rozpuszczeniu uzyskać roztwór o stężeniu 30%? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie masy roztworu azotanu(V) srebra, jaką można uzyskać w wyniku odparowania wody
W laboratorium dysponowano 280 gramami 20-procentowego wodnego roztworu azotanu(V) srebra.
Oblicz, jaką masę roztworu o stężeniu 50% można uzyskać na drodze odparowania wody z opisanego roztworu? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Otrzymywanie roztworu azotanu(V) srebra o określonym stężeniu procentowym na drodze odparowania rozpuszczalnika
Gęstość 40% roztworu azotanu(V) srebra w temperaturze 25 OC wynosi 1,48 g/cm3.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Oblicz, jaką masę wody należy odparować, aby ze 150 g podanego w informacji wprowadzającej roztworu otrzymać roztwór 50-procentowy? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Sporządzanie roztworu kwasu azotowego(V) na drodze mieszania roztworów
Wodny roztwór kwasu azotowego(V) o stężeniu 65% w temperaturze 298 K ma gęstość 1,4 g/cm³.
W jakim stosunku objętościowym należy zmieszać ze sobą 65% roztwór kwasu azotowego(V) z 0,1-molowym roztworem tego kwasu, aby uzyskać roztwór 2-molowy? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone