Obliczanie niezbędnej do przeprowadzenia reakcji chemicznej objętości powietrza
Antymon może występować w tzw. żółtej postaci tworząc kilkuatomowe cząsteczki. Taką odmianę alotropową antymonu otrzymuje się w reakcji jego wodorku o wzorze SbH3 (antymonowodoru) z ciekłym tlenem, przy czym stosunek molowy powstałych produktów reakcji (antymonu oraz wody) wynosi odpowiednio 1:6.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Jakiej objętości powietrza odmierzonego w warunkach normalnych należy użyć, w celu uzyskania 61 g antymonu? Wynik obliczeń podaj z dokładnością do cyfry jedności. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie zawartości pierwiastka w próbce mieszaniny użytej do reakcji chemicznej
W celu oczyszczenia próbki srebra zanieczyszczonej tlenkami ZnO oraz CuO, w jednym z etapów procesu poddaje się ją działaniu nadmiaru roztworu kwasu solnego. W wyniku działania kwasu solnego na próbkę zanieczyszczonego srebra powstał roztwór zawierający 13,6 g chlorku cynku oraz 6,75 g chlorku miedzi(II).
Oblicz liczbę atomów srebra w próbce, jeśli wymienione zanieczyszczenia stanowiły 20% jej masy. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie masy powstałego tlenku azotu(IV) na podstawie znanej masy oraz objętości mieszaniny substratów
Reakcja utleniania tlenku azotu(II) ozonem przebiega zgodnie z równaniem:
NO + O3 → NO2 + O2
Oblicz, jaką masę tlenku NO2 otrzymano, jeśli przygotowana mieszanina substratów o masie 32,4 g w temperaturze 303 K i pod ciśnieniem 1007 hPa zajmowała objętość 20 dm3? Przyjmij, że uniwersalna stała gazowa ma wartość 83,1 hPa∙dm3∙mol–1∙K–1. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie wzoru półstrukturalnego oraz nazwy systematycznej estru
Najprostszy alkohol aromatyczny i produkt jego reakcji z nadmiarem zakwaszonego roztworu manganianu(VII) potasu tworzą ester, którego cząsteczki mają jeden atom węgla o hybrydyzacji orbitali walencyjnych typu sp3. Jednym z produktów reakcji jego hydrolizy w wodnym roztworze wodorotlenku potasu jest popularny konserwant żywności.
Podaj wzór półstrukturalny oraz nazwę opisanego estru. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równania reakcji chemicznej tworzenia estru z udziałem bezwodnika kwasowego
W chemii organicznej bezwodniki kwasowe określa się mianem pochodnych kwasów (na przykład) mono- i dikarboksylowych. Pochodne te obok alkoholi i fenoli służą jako substraty w reakcjach otrzymywania estrów według ogólnego schematu:
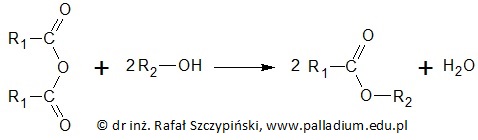
Na przedstawionym schemacie R1 oraz R2 oznaczają reszty węglowodorowe znajdujące się w cząsteczce odpowiednio – bezwodnika kwasowego oraz alkoholu lub fenolu.
Produktem pewnej reakcji estryfikacji biegnącej z udziałem bezwodnika kwasowego jest 2-metylopropionian metylu.
Korzystając z grupowych wzorów związków organicznych napisz równanie opisanej przemiany i podaj systematyczną nazwę kwasu, którego bezwodnik wykorzystano. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równania reakcji estryfikacji z udziałem bezwodnika kwasowego oraz określenie nazwy estru (izomeria geometryczna)
W chemii organicznej bezwodniki kwasowe określa się mianem pochodnych kwasów (na przykład) mono- i dikarboksylowych. Pochodne te obok alkoholi i fenoli służą jako substraty w reakcjach otrzymywania estrów według ogólnego schematu:

Na przedstawionym schemacie R1 oraz R2 oznaczają reszty węglowodorowe znajdujące się w cząsteczce odpowiednio – bezwodnika kwasowego oraz alkoholu lub fenolu.
Wśród pochodnych kwasów dikarboksylowych znanych jest wiele cyklicznych bezwodników kwasowych. Przykładem takiego związku chemicznego jest bezwodnik maleinowy (pochodna kwasu cis-butenodiowego).
Korzystając z grupowych wzorów związków organicznych napisz równanie reakcji estryfikacji z wykorzystaniem tego bezwodnika, gdy drugim jej substratem jest etanol. Podaj nazwę powstałego estru. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Rysowanie wzorów półstrukturalnych bezwodnika kwasowego oraz produktu estryfikacji z jego udziałem
W chemii organicznej bezwodniki kwasowe określa się mianem pochodnych kwasów (na przykład) mono- i dikarboksylowych. Pochodne te obok alkoholi i fenoli służą jako substraty w reakcjach otrzymywania estrów według ogólnego schematu:

Na przedstawionym schemacie R1 oraz R2 oznaczają reszty węglowodorowe znajdujące się w cząsteczce odpowiednio – bezwodnika kwasowego oraz alkoholu lub fenolu.
Podczas ogrzewania kwasu benzeno-1,2-dikarboksylowego otrzymuje się bezwodnik ftalowy. W wyniku przebiegającej reakcji chemicznej masa jednego mola cząsteczek kwasu zmniejsza się o 18 g.
Narysuj wzory półstrukturalne cząsteczek uzyskanego bezwodnika oraz produktu jego estryfikacji alkoholem izopropylowym, jeśli stosunek molowy substratów (bezwodnika do alkoholu) wykorzystanych w tej reakcji wynosi 1:2. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie nazw systematycznych wskazanych wyższych kwasów nienasyconych
Olej lniany jest mieszaniną tłuszczy zawierających reszty kilku różnych wyższych kwasów nienasyconych, głównie oleinowego, linolowego oraz linolenowego. Cząsteczki wymienionych kwasów różnią się liczbą wiązań podwójnych C=C. W tabeli poniżej zebrano informacje na temat liczby oraz umiejscowienia w łańcuchu węglowym wiązań podwójnych między atomami węgla.
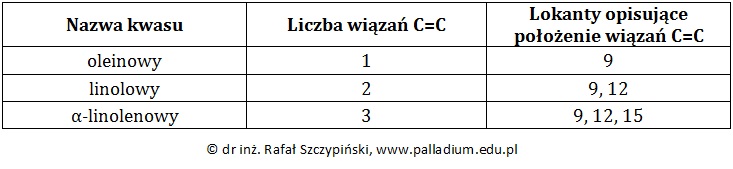
Podaj nazwy systematyczne wymienionych wyższych nienasyconych kwasów tłuszczowych jeśli wiadomo, że w wyniku całkowitego uwodornienia łańcucha węglowego każdego z nich powstaje kwas stearynowy. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Rysowanie stereochemicznych wzorów enancjomerów tłuszczu o określonej liczbie jodowej (izomeria optyczna)
Liczba jodowa (Lj) określa masę jodu, jaka przyłącza się do 100 g tłuszczu. Dla pewnego trójglicerydu o masie cząsteczkowej równej 888 u liczba jodowa wynosi 28,6 g.
Wiedząc, że jedna z reszt kwasowych tego związku chemicznego jest pochodną drugiej z nich, a stosunek wagowy uzyskanych w wyniku jego zmydlenia soli sodowych równy jest 2:1, narysuj wzory stereochemiczne cząsteczek obu enancjomerów opisanego trójglicerydu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Przypisywanie obserwacji do przeprowadzonego eksperymentu
Przeprowadzono doświadczenie chemiczne z udziałem oleju rzepakowego, stearyny oraz benzyny. Zawartość probówki z substancją stałą była ogrzewana, ale dopiero po dodaniu do niej drugiego odczynnika.
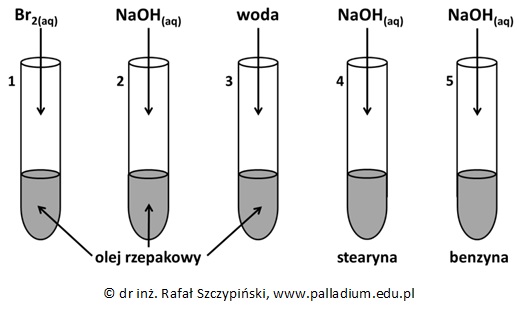
Po dodaniu stechiometrycznej ilości drugiego z odczynników, zawartością każdej z probówek energicznie wstrząśnięto.
Napisz, co zaobserwowano w probówkach z olejem rzepakowym do których dodano drugi odczynnik i wstrząśnięto ich zawartością? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone

