27.10.2019 | 0 komentarze

Mówiąc o wpływie pH środowiska na właściwości utleniająco-redukujące drobin (cząsteczek lub jonów) mamy na myśli zwiększanie, albo zmniejszanie ich właściwości utleniających (albo redukujących). Wpływ ten można zaobserwować podczas reakcji jonów manganianowych(VII) z odpowiednim reduktorem, na przykład jonami siarczanowymi(IV). Schemat takiego doświadczenia ilustruje rysunek poniżej.
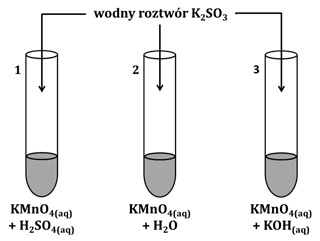
W środowisku silnie kwasowym, obecne w pierwszej probówce jony MnO4– redukują się do kationów Mn2+:
2MnO4– + 6H+ + 5SO32- ⟶ 2Mn2+ + 5SO42- + 3H2O
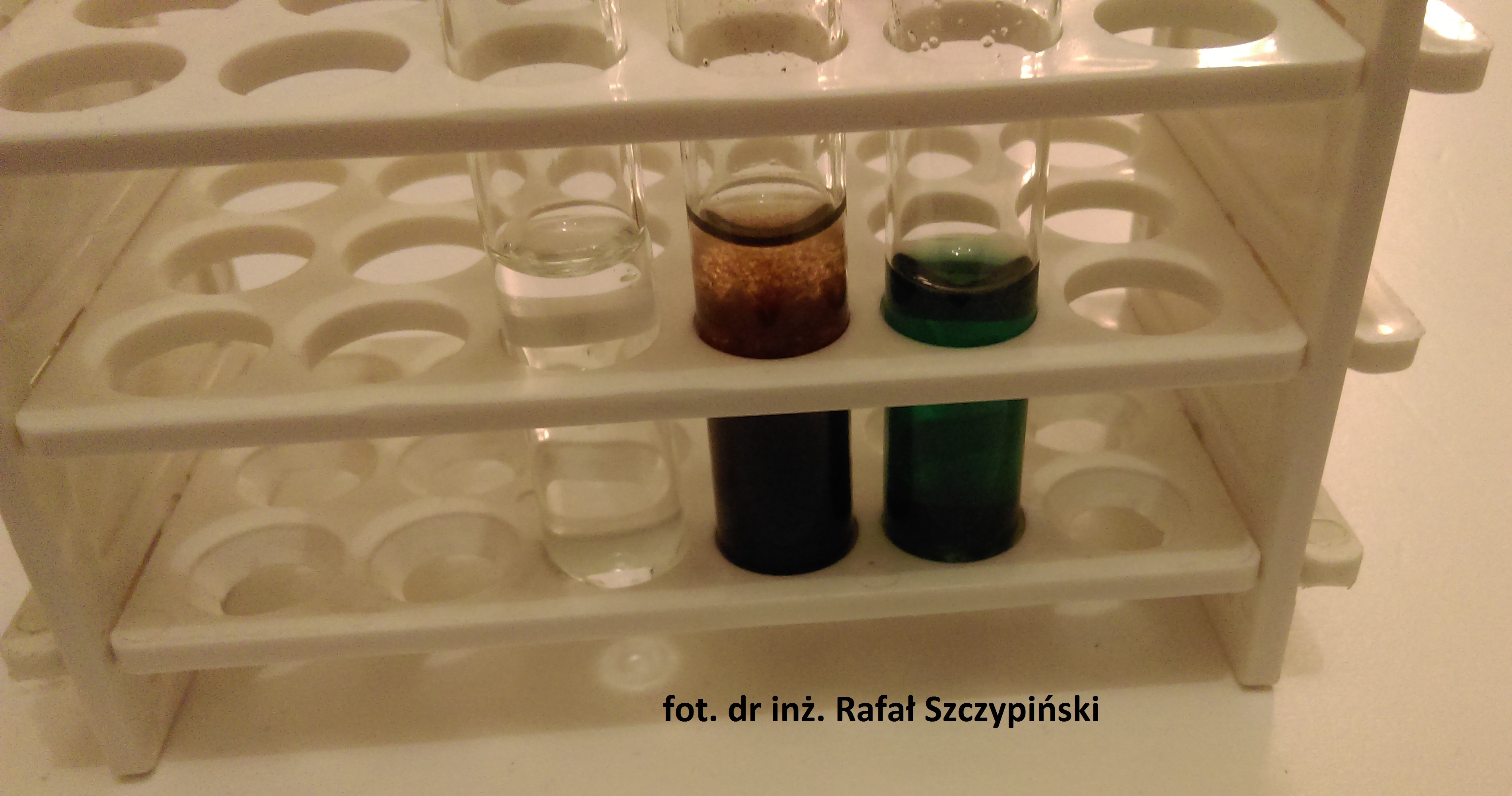
Podstawowym objawem przebiegającej reakcji redukcji jonów 2MnO4– do jonów Mn2+ w środowisku kwasowym jest odbarwienie się roztworu, lub (w przypadku wysokich stężeń jonów) zmiana jego zabarwienia na kolor różowy.
Nie jest to jednak jedyny objaw przebiegającej reakcji chemicznej. Zwróć uwagę, że do zakwaszonego kwasem siarkowym(VI) roztworu manganianu(VII) potasu wprowadzony został wodny roztwór siarczanu(IV) potasu – soli pochodzącej od słabego i nietrwałego kwasu siarkowego(IV). W roztworze, równolegle przebiegnie wówczas reakcja opisana równaniem:
SO32- + 2H+ ⟶ SO2 + H2O
Dodatkowym objawem przebiegającej reakcji utleniania jonów SO32- do jonów SO42- w środowisku kwasowym jest wydzielanie się bezbarwnego gazu o charakterystycznej, drażniącej woni.
W środowisku obojętnym (druga probówka) jony MnO4– redukują się do tlenku MnO2:
2MnO4– + H2O + 3SO32- ⟶ 2MnO2 + 3SO42- + 2OH–
Podstawowym objawem przebiegającej reakcji redukcji jonów MnO4– do MnO2 w środowisku wodnym jest odbarwienie się roztworu oraz strącenie brunatnego osadu.
W środowisku silnie zasadowym (trzecia probówka) jony MnO4– redukują się do jonów MnO42-:
2MnO4– + 2OH– + SO32- ⟶ 2MnO42- + SO42- + H2O
Podstawowym objawem przebiegającej reakcji redukcji jonów MnO4– do MnO42- w środowisku silnie zasadowym jest zmiana barwy roztworu z fioletowej na zieloną.
Na fotografii poniżej możesz zobaczyć efekt przeprowadzonych reakcji chemicznych z udziałem manganianu(VII) potasu oraz siarczanu(IV) potasu w środowiskach o różnym pH roztworu.
Wiesz już teraz, że pH środowiska reakcyjnego ma istotny wpływ na rodzaj powstającego produktu podczas reakcji redoks z udziałem jonów manganianowych(VII). Teraz spróbuj zmierzyć się z kilkoma zadaniami dotyczącymi opisanego zagadnienia. Znajdziesz je pod tymi linkami:
zadanie 1, zadanie 2, zadanie 3, zadanie 4.
Chcesz wiedzieć więcej na temat innych, podobnie przebiegających reakcji chemicznych? Projektowanie doświadczeń chemicznych szczegółowo opisałem w podręczniku pt. „Projektowanie doświadczeń chemicznych. Dla maturzystów i nie tylko”. Informacje o książce znajdziesz tutaj.
Spodobał Ci się ten artykuł? Polub mój fanpage na Facebooku oraz na Instagramie, aby nie ominęły Cię żadne nowości.
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone