27.10.2019 | 0 komentarze

Zdolności utleniające jonów manganianowych(VII) maleją wraz ze wzrostem wartości pH roztworu w jakim się znajdują. W konsekwencji, wśród produktów reakcji pojawiają się drobiny oraz związki chemiczne, w których pierwiastek ten może przyjmować stopień utlenienia II, IV lub VI, o czym możesz przeczytać tutaj.
Interesująco przedstawia się reakcja utleniania toluenu za pomocą jonów manganianowych(VII). W zależności od środowiska prowadzenia takiej przemiany, jej organicznym produktem może być kwas benzoesowy lub jego sól zawierająca aniony benzoesanowe.
W artykule zaprezentuję zmiany, jakie można zaobserwować podczas przebiegu dwóch takich reakcji chemicznych. Na zamieszczonych kolejno fotografiach, w probówce po lewej stronie utlenianie toluenu prowadzono w środowisku kwasowym (wobec H2SO4), natomiast w probówce po prawej stronie – w obojętnym (woda destylowana).
Fotografia nr 1 – chwilę po dodaniu toluenu do obu probówek zmiany praktycznie nie są zauważalne.

Po rozpoczęciu ogrzewania na łaźni wodnej (temperatura 80 – 90 OC) przez około 1 minutę reakcja zaczęła przebiegać o wiele szybciej, o czym świadczy pojawienie się różowego zabarwienia – probówka po lewej stronie oraz brunatnego osadu (probówka po prawej stronie). Fotografia nr 2 przedstawia efekt uzyskany po 5 minutach od zakończenia ogrzewania.

Po upływie kolejnych 10 minut:

Na ostatniej fotografii (poniżej) widzimy efekt końcowy przeprowadzonego eksperymentu. Zdjęcie wykonane zostało po 6 godzinach od zakończenia ogrzewania. W probówce po lewej stronie widoczny jest wyraźnie bladoróżowy roztwór; w probówce po prawej stronie obserwujemy brunatny osad, który częściowo uległ sedymentacji i opadł na dno naczynia reakcyjnego.

Warto zwrócić uwagę na obecność frakcji organicznej – znajduje się ona w górnej części każdej z probówek, przy czym jej ilość jest wyraźnie mniejsza, niż przed rozpoczęciem ogrzewania zawartości obu naczyń. Jest to dowód, że część toluenu uległa reakcji chemicznej. Jednocześnie możemy wnioskować, że węglowodór ten ma gęstość mniejszą od gęstości wody oraz powstałego roztworu. Na koniec zapiszmy w formie jonowej skróconej zbilansowane równania reakcji chemicznych, jakie przebiegły w każdym z naczyń.
Probówka, w której znajdował się zakwaszony roztwór manganianu(VII) potasu:
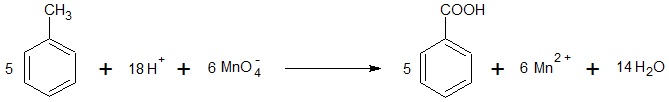
Probówka, w której znajdował się wodny roztwór manganianu(VII) potasu:
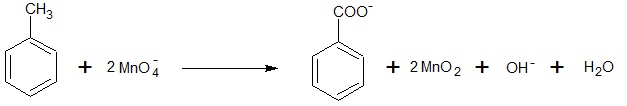
Spodobał Ci się ten artykuł? Polub mój fanpage na Facebooku oraz na Instagramie, aby nie ominęły Cię żadne nowości.
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone