21.08.2021 | 0 komentarze

Podczas prac laboratoryjnych często wykorzystuje się serie roztworów różniących się stężeniami. Przykładem zastosowania takiej serii jest technika tzw. krzywej wzorcowej, która polega na ustaleniu zależności między stężeniem substancji oznaczanej i natężeniem jego fluorescencji w ściśle określonym zakresie stężeń. W zakresie tym natężenie fluorescencji jest proporcjonalne do stężenia substancji emitującej światło o określonej długości fali. Przykładową krzywą wzorcową roztworów soli sodowej fluoresceiny (SF) w zakresie stężeń od 10–3 ng·ml–1 do 104 ng·ml–1 ilustruje rysunek nr 1. Z przedstawionego na tym rysunku wykresu wynika, że liniową zależność natężenia fluorescencji od stężenia soli sodowej fluoresceiny obserwuje się w zakresie stężeń od 1 ng·ml–1 do 104 ng·ml–1.
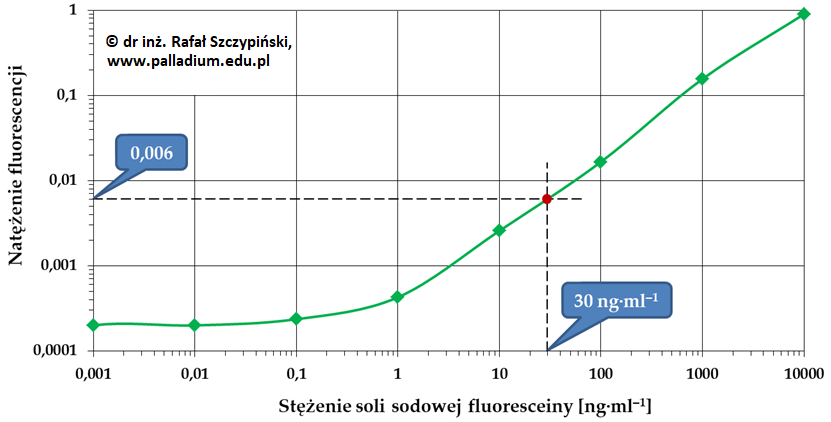
Rys. 1. Krzywa wzorcowa sporządzona z wykorzystaniem roztworów soli sodowej fluoresceiny (kolor zielony) oraz naniesiony na krzywą punkt pomiarowy (kolor czerwony) odpowiadający badanemu roztworowi o nieznanym stężeniu (opis w tekście poniżej). Pomiary natężenia fluorescencji zostały wykonane w Instytucie Biocybernetyki i Inżynierii Biomedycznej im. M. Nałęcza Polskiej Akademii Nauk w Warszawie w ramach rozprawy doktorskiej pt. „Moduł mikroprzepływowy do pomiarów cytometrycznych”.
Znając wartość natężenia fluorescencji badanej próbki można odczytać jej stężenie z krzywej wzorcowej. Na przykład, jeśli wyznaczona w przedstawionym układzie pomiarowym (rys. 1) wartość natężenia fluorescencji wynosi 0,006 (oś pionowa), to odpowiadające jej stężenie próbki odczytane z krzywej wzorcowej wynosi 30 ng·ml–1. Opisany punkt pomiarowy został na wykresie zaznaczony kolorem czerwonym, w miejscu przecięcia dwóch przerywanych linii pomocniczych.
Przygotowanie serii roztworów do badań
Zakres stężeń, w którym bada się natężenie fluorescencji wynosi zwykle od kilku pg·ml–1 (pikogramów na mililitr) do kilkuset µg·ml–1 (mikrogramów na mililitr). Sporządzenie w sposób klasyczny (poprzez każdorazowe odważenie substancji rozpuszczanej) roztworów o tak niskich stężeniach jest praktycznie niemożliwe, ponieważ dostępne na rynku ultra-mikrowagi pozwalają na przygotowanie odważek o masach nie mniejszych, niż setne części miligrama (stan na rok 2018, www.labindex.pl). W celu przygotowania roztworów o tak niewielkich stężeniach (pikogramy stanowią bilionową część grama 10–12 g) stosuje się tzw. metodę kolejnych rozcieńczeń. Technika ta polega w pierwszej kolejności na przygotowaniu roztworu początkowego o ściśle określonym stężeniu np. rzędu kilku miligramów na mililitr (mg·ml–1) oraz objętości. Kolejne (o coraz to mniejszym stężeniu) roztwory zwykle przygotowuje się w naczynkach zwanych probówkami Eppendorf (rysunek nr 2), a sama procedura nie jest skomplikowana.

Rys. 2. Seria siedmiu roztworów znajdujących się w przezroczystych probówkach Eppendorf. Intensywność zabarwienia zawartości kolejnych naczyń odpowiada coraz to mniejszemu stężeniu substancji rozpuszczonej. Próbka oznaczona cyfrą 1 stanowi roztwór początkowy.
Roztwór bazowy (o określonym stężeniu molowym lub masowym) przygotowuje się w sposób „klasyczny” o czym napisałem w artykule: „Przygotowanie roztworu o określonym stężeniu procentowym, molowym oraz masowym”. Z roztworu początkowego (oznaczonego cyfrą 1) pobiera się ściśle określoną jego objętość, zależną od stopnia (krotności) rozcieńczenia, jaką chcemy uzyskać. Objętość taką obliczamy z zależności:
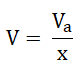
W podanym wzorze pozostałe wielkości oznaczają kolejno:
Va – objętość roztworu, z którego pobieramy próbkę (w każdym z etapów jest taka sama); x – krotność rozcieńczenia, która w każdym z etapów jest taka sama.
Następnie do zawartości probówki, w której umieściliśmy wyliczoną powyższą metodą objętość roztworu dodaje się ściśle określoną objętość rozpuszczalnika (Vrozp), którą można obliczyć z zależności:
![]()
Gdzie x to krotność rozcieńczenia – taka sama, jak dla policzonej objętości V.
Jak będzie to wyglądać w praktyce? Załóżmy, że dysponujemy wyjściowym roztworem wodnym o stężeniu substancji rozpuszczonej równym 2 mg·ml–1 i objętości 1,5 ml. Chcąc uzyskać roztwór o dziesięciokrotnie niższym stężeniu względem stężenia początkowego, wówczas x = 10. Roztwór taki będzie miał zatem stężenie równe 0,2 mg·ml–1 i objętość 1,5 ml. Należy zatem pobrać:
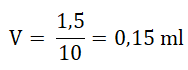
roztworu o stężeniu 2 mg·ml–1, a następnie dopełnić wodą destylowaną o objętości:
![]()
Cykl polegający na przygotowaniu roztworu o dziesięciokrotnie mniejszym stężeniu został w ten sposób zamknięty. Roztwór kolejny (o stężeniu 0,02 mg·ml–1) uzyskuje się z roztworu o stężeniu 0,2 mg·ml–1 w sposób analogiczny jak opisano powyżej. Naszym roztworem bazowym będzie tym razem układ oznaczony na rys. 2 cyfrą 2. Z roztworu tego pobieramy zatem próbkę o objętości 0,15 ml i przenosimy do probówki nr 3, a następnie dodajemy do niej 1,35 ml wody destylowanej. W ten sposób uzyskaliśmy roztwór o stężeniu o stężeniu 0,02 mg·ml–1. Wymienione czynności wykonujemy do momentu uzyskania serii kilku (lub nawet kilkunastu) roztworów. Na koniec warto wspomnieć, że z uwagi na niewielkie stężenia kolejno rozcieńczanych roztworów, zjawisko kontrakcji praktycznie nie jest wówczas obserwowane, dlatego też można je pominąć.
Spodobał Ci się ten artykuł? Polub mój fanpage na Facebooku oraz na Instagramie, aby nie ominęły Cię żadne nowości.
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone