24.11.2019 | 0 komentarze

Reakcje dotyczące równowag w roztworach wodnych z udziałem wodorotlenków amfoterycznych zdarzają się w każdym arkuszu maturalnym i często sprawiają problem. W tym artykule nieco przybliżę Wam to zagadnienie, zaczynając od tego, że wodorotlenki amfoteryczne są trudno rozpuszczalnymi w wodzie związkami chemicznymi…
Jak zapewne pamiętasz – rozpuszczalność substancji jest to maksymalna jej ilość, jaką można rozpuścić w danym rozpuszczalniku, w określonych warunkach ciśnienia i temperatury. Należy jednocześnie podkreślić, że nie istnieją substancje nierozpuszczalne, lecz trudno rozpuszczalne, albo ściślej rzecz ujmując – praktycznie nierozpuszczalne. Oznacza to, że część wprowadzonego do rozpuszczalnika ciała stałego zawsze (choć w niewielkiej ilości) rozpuści się w nim. Kiedy w roztworze niemożliwe jest już rozpuszczenie większej ilości substancji, to wówczas roztwór taki nazywa się nasyconym. Gdy do tego rodzaju układu wprowadzi się kolejne porcje substancji rozpuszczonej, wówczas opadną one na dno naczynia tworząc osad, przy czym, jeśli rozpuszczalnikiem jest woda, mówimy wtedy o wodnej zawiesinie. W układzie takim, między osadem, a nasyconym roztworem substancji rozpuszczonej ustala się wówczas równowaga dynamiczna. W przypadku związków o budowie jonowej (lub o przeważającym udziale wiązania jonowego) równowagę taką opisuje wielkość zwana iloczynem rozpuszczalności (Kso). Jest to iloczyn stężeń molowych jonów w nasyconym roztworze substancji trudno rozpuszczalnej. Na przykład w wodnej zawiesinie wodorotlenku żelaza(II), ustala się równowaga dynamiczna:
Fe(OH)2(s) ⇄ Fe2+(aq) + 2OH–(aq)
W temperaturze 25 oC wyrażenie opisujące powyższą równowagę ma wartość 7,94∙10–16 i przyjmuje postać:
Kso = [Fe2+]∙[OH–]2
Z powyższego równania wynika, że wartość iloczynu rozpuszczalności zależy nie tylko od stężenia znajdujących się w roztworze jonów Fe2+, ale i od stężenia jonów OH–, a w konsekwencji od wartości pH roztworu. Dlatego też, jeśli do nasyconego w danej temperaturze roztworu wodorotlenku żelaza(II) wprowadzi się dodatkową liczbę jonów Fe2+, wówczas (zgodnie z regułą przekory Le Chateliera-Brauna) układ będzie przeciwdziałał tej zmianie. W konsekwencji przebiegnie reakcja w lewo, która spowoduje związanie nadmiarowej liczby wprowadzonych jonów przez obecne w roztworze aniony wodorotlenkowe i powstanie osad wodorotlenku żelaza(II). Podobnie, gdy wprowadzimy do układu dodatkowe jony wodorotlenkowe, wówczas zostaną one związane przez obecne w roztworze kationy Fe2+.
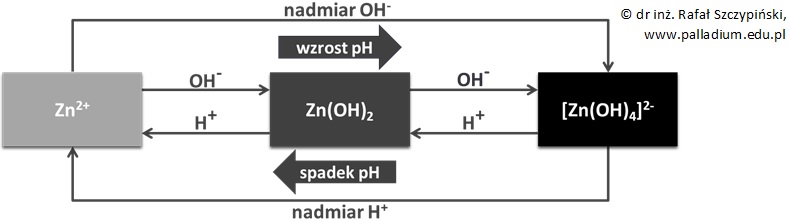
Przedstawiony powyżej przykład dotyczy wodorotlenku o charakterze zasadowym. W przypadku wodorotlenków amfoterycznych – na przykład Zn(OH)2 sprawa jest nieco bardziej skomplikowana, ponieważ w zależności od pH roztworu oraz stężenia kationów metalu, w fazie wodnej mogą ustalać się ponadto inne równowagi jonowe. Im niższa jest wartość pH roztworu, tym dominować w nim będą wówczas jony Zn2+. Zwiększając stopniowo pH osiągniemy taką jego wartość, przy której zacznie strącać się osad wodorotlenku cynku:
Zn2+ + 2OH– ⟶ Zn(OH)2↓
Wprowadzając kolejne porcje roztworu mocnej zasady do uzyskanej zawiesiny wodorotlenku cynku zwiększymy tym samym liczbę jonów wodorotlenkowych w układzie. Ponieważ Zn(OH)2 jest wodorotlenkiem o charakterze amfoterycznym, to przy określonej wartości pH osad tego związku chemicznego zacznie się roztwarzać. Poskutkuje to utworzeniem się jonów tetrahydroksocynkanowych:
Zn(OH)2 + 2OH– ⟶ [Zn(OH)4]2–
Zadajmy sobie zatem pytanie: czy możliwy jest proces odwrotny – przejście od wyżej opisanego roztworu związku kompleksowego do roztworu zawierającego jony Zn2+? Przemiana taka może zostać zrealizowana, przy czym konieczne jest wówczas obniżenie pH roztworu – na przykład poprzez ostrożne wprowadzenie kwasu solnego. Po osiągnięciu odpowiedniej wartości pH układu reakcyjnego zaobserwujemy najpierw strącenie się białego, galaretowatego osadu:
[Zn(OH)4]2– + 2H+ ⟶ Zn(OH)2↓ + 2H2O
Gdy do uzyskanej w ten sposób zawiesiny wprowadzi się kolejne porcje kwasu, wówczas osad ulegnie całkowitemu roztworzeniu:
Zn(OH)2 + 2H+ ⟶ Zn2+ + 2H2O
Opisane wyżej przemiany można przedstawić w sposób schematyczny w następującej postaci:
Na znajdującej się poniżej fotografii możesz zobaczyć uzyskany efekt w pewnym momencie doświadczenia, podczas którego do roztworu związku kompleksowego cynku (Na2[Zn(OH)4]) po ściankach probówki ostrożnie wprowadzono roztwór kwasu solnego. Widoczny na granicy obu roztworów osad to wodorotlenek cynku. Papierek wskaźnikowy obrazuje odczyn obu roztworów (znajdującego się nad oraz poniżej osadu).

Zadania z udziałem związków chemicznych pierwiastków bloków s oraz p znajdziesz tutaj, natomiast z zakresu iloczynu rozpuszczalności – pod tym linkiem.
Więcej informacji na temat równowag jonowych oraz innych zagadnień związanych z doświadczeniami chemicznymi znajdziesz w podręczniku „Projektowanie doświadczeń chemicznych. Dla maturzystów i nie tylko”.
Spodobał Ci się ten artykuł? Polub mój fanpage na Facebooku oraz na Instagramie, aby nie ominęły Cię żadne nowości.
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone