10.11.2019 | 0 komentarze

W każdym arkuszu maturalnym spotkasz się z co najmniej jednym zadaniem, w którym konieczne będzie przypisanie wartości stopni utlenienia pierwiastkom w związku chemicznym bądź jonie. W tym krótkim artykule przedstawię Ci, w jaki sposób można tego dokonać na podstawie znajomości wzoru strukturalnego związku organicznego oraz wartości elektroujemności pierwiastków.
Pomimo, że procedura przypisywania wartości stopni utlenienia pierwiastkowi obejmuje kilka etapów, to jest ona stosunkowo szybka do wykonania:
1. Z układu okresowego pierwiastków chemicznych odczytujemy wartości elektroujemności: pierwiastka, któremu chcemy przypisać stopień utlenienia oraz pierwiastków, które bezpośrednio są z nim połączone wiązaniami kowalencyjnymi, kowalencyjnymi spolaryzowanymi lub (ewentualnie) wiązaniem koordynacyjnym (które to jest tak naprawdę szczególnym rodzajem wiązania kowalencyjnego spolaryzowanego).
2. Pierwiastek o wyższej wartości elektroujemności „przyciąga” w swoim kierunku elektron od swojego bezpośredniego sąsiada (pierwiastka, z którym połączony jest wiązaniem chemicznym). W przypadku wiązania pojedynczego mówimy wówczas o przyciąganiu jednego elektronu. Dla wiązania podwójnego są to dwa elektrony, natomiast potrójnego – trzy elektrony. Z kolei w przypadku wiązania koordynacyjnego mówimy wtedy o dwóch takich elektronach.
3. Każdy „wyciągnięty” od rozpatrywanego pierwiastka elektron oznacza jeden ładunek ujemny odebrany temu pierwiastkowi, co powoduje wzrost jego stopnia utlenienia o jedną jednostkę; natomiast każdy „ściągnięty” elektron przez rozpatrywany pierwiastek oznacza jeden ładunek ujemny przyłączony do tego pierwiastka, co powoduje obniżenie jego stopnia utlenienia o jedną jednostkę.
4. Dla rozpatrywanego pierwiastka obliczamy bilans „ściągniętych” przez niego oraz „wyciągniętych” od niego elektronów, co kończy całą procedurę przypisywania stopnia utlenienia.
UWAGA: nie rozpatrujemy połączeń między atomami tego samego pierwiastka chemicznego z uwagi na taką samą wartość elektroujemności.
Poniżej zamieszczony został wzór cząsteczki 2-hydroksypropanianu etylu, w której przypisane zostaną wartości stopni utlenienia wybranym pierwiastkom chemicznym, umownie oznaczonym cyframi 1, 2, 3 i literami A, B, X oraz Y.
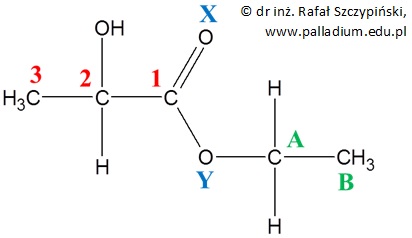
Z układu okresowego odczytujemy wartości elektroujemności poszczególnych pierwiastków chemicznych: 2,5 – węgiel, 2,1 – wodór, 3,5 – tlen.
Rozpatrzmy teraz atomy węgla – oznaczony cyfrą 3 oraz literą B. Węgiel ma wyższą wartość elektroujemności niż wodór, zatem „przyciąga” w swoim kierunku po jednym elektronie od każdego z atomów wodoru, stąd każdemu z tych atomów przypiszemy stopień utlenienia równy -3. Można to zapisać równaniem: +3∙(-1) = -3. Znak „+” zapisany przed cyfrą 3 w tym równaniu oznacza, że elektron jest przyciągany przez rozpatrywany atom węgla od każdego z trzech atomów wodoru.
Atom węgla oznaczony cyfrą 2 „przyciąga” elektron od atomu wodoru i jednocześnie połączony z tym atomem węgla atom tlenu „przyciąga” od tego atomu węgla elektron, ponieważ tlen ma wyższą wartość elektroujemności niż węgiel. Atomowi węgla oznaczonemu cyfrą 2 przypiszemy zatem stopień utlenienia równy 0. Można to zapisać równaniem: +1∙(-1) – (-1) = 0. Znak „-” znajdujący się pomiędzy nawiasami oznacza, że elektron jest „wyciągany” od atomu węgla.
Od atomu węgla oznaczonego cyfrą 1 połączony z nim wiązaniem podwójnym atom tlenu „przyciąga” dwa elektrony, a atom tlenu połączony z tym atomem węgla wiązaniem pojedynczym „przyciąga” jeden elektron. Zatem atomowi węgla oznaczonemu cyfrą 1 przypiszemy stopień utlenienia równy 3. Można to zapisać równaniem: -2∙(-1) – (-1) = 3.
Atom węgla oznaczony literą A „przyciąga” od połączonych z nim atomów wodoru po jednym elektronie i jednocześnie połączony z tym atomem węgla atom tlenu „wyciąga” od niego jeden elektron. Zatem atomowi węgla oznaczonemu literą A przypiszemy stopień utlenienia równy -1. Można to zapisać równaniem: +2∙(-1) – (-1) = -1.
Pewnym wzbudzającym liczne wątpliwości odnośnie stopni utlenienia pierwiastków związkiem chemicznym jest nitrobenzen, którego cząsteczkę można przedstawić wzorem:
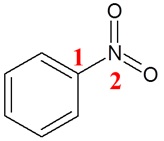
Atom azotu oznaczony cyfrą 2 „przyciąga” jeden elektron od atomu węgla oznaczonego cyfrą 1. Dzieje się tak, ponieważ azot ma większą wartość elektroujemności, niż węgiel. Atomowi węgla oznaczonemu cyfrą 1 przypiszemy zatem stopień utlenienia równy 1, co można zapisać równaniem -(-1) = 1. Jednocześnie każdy z atomów tlenu „przyciąga” po dwa elektrony od atomu azotu, ponieważ tlen ma większą wartość elektroujemności, niż azot. Atomowi azotu przypiszemy zatem stopień utlenienia równy 3, co można zapisać równaniem: +1∙(-1) – 2∙(-2) = 3.
Mam nadzieję, że teraz bez problemów będziesz w stanie przypisać wartości stopni utlenienia pierwiastkom chemicznym w poszczególnych związkach organicznych. Możesz przećwiczyć to zagadnienie rozwiązując kilka związanych z nim zadań: zadanie 1, zadanie 2, zadanie 3, zadanie 4, zadanie 5, zadanie 6, zadanie 7, zadanie 8, zadanie 9.
Spodobał Ci się ten artykuł? Polub mój fanpage na Facebooku oraz na Instagramie, aby nie ominęły Cię żadne nowości.
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone