20.11.2020 | 0 komentarze

Zawartość substancji rozpuszczonej w mieszaninie, jaką stanowi jej roztwór, można wyrażać na wiele różnych sposobów. Na poziomie matury rozszerzonej spotykamy się zwykle ze stężeniem procentowym oraz molowym roztworów substancji. Z tego tekstu dowiesz się, w jaki sposób przygotowuje się wodne roztwory związków chemicznych, w których zawartość substancji rozpuszczonej wyraża się za pomocą wyżej wymienionych stężeń. Każdorazowo do dyspozycji będziemy mieć związek bezwodny lub hydrat oraz niezbędne do wykonania doświadczenia szkło laboratoryjne.
Stężenie procentowe substancji rozpuszczonej
Stężenie procentowe roztworu określa się mianem zawartości procentowej (procentu wagowego) substancji rozpuszczonej, jaka znajduje się w 100 g roztworu. Na przykład w 100 g wodnego roztworu glukozy o stężeniu równym 20% znajduje się 20 g tego cukru (substancja rozpuszczona) oraz 80 g wody (rozpuszczalnik).
Załóżmy teraz, że naszym celem jest przygotowanie 200 g roztworu glukozy o stężeniu 15%, jeśli dysponujemy bezwodną próbką tego cukru oraz wodą destylowaną. Aby sporządzić opisany roztwór, najpierw należy obliczyć zawartą w nim masę substancji rozpuszczonej (glukozy). W tym celu ze wzoru:
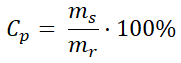
wyznaczamy wielkość ms, stanowiącą wyrażoną w gramach masę substancji rozpuszczonej. W podanym wzorze pozostałe wielkości to:
Cp – stężenie procentowe roztworu,
mr – masa roztworu, na którą składają się: masa substancji rozpuszczonej oraz masa rozpuszczalnika (np. wody).
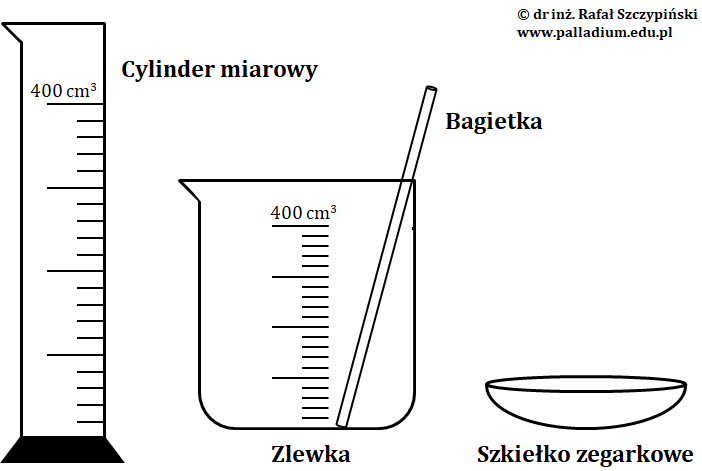
Obliczona w tym przypadku masa glukozy wynosi 30 g. Wartość tę obliczamy po przekształceniu podanego wyżej wzoru, z którego wyznaczamy wielkość ms. Na szkiełku zegarkowym odważamy tę ilość cukru i przesypujemy do zlewki. Następnie, w cylindrze miarowym odmierzamy 170 cm3 wody destylowanej. Objętość ta odpowiada masie wody stanowiącej różnicę między masą roztworu (200 g), a masą glukozy (30 g). Zawartość tego naczynia przelewamy do zlewki zawierającej przygotowaną odważkę cukru i mieszamy za pomocą bagietki.
Nieco inaczej przedstawia się sytuacja, gdy dysponujemy hydratem danej soli. Załóżmy teraz, że naszym celem jest przygotowanie 250 g roztworu siarczanu(VI) miedzi(II) o stężeniu 6,4%, jeśli dysponujemy pięciowodnym hydratem tej soli, którego wzór sumaryczny to CuSO4͘ · 5H2O. Aby sporządzić opisany roztwór, najpierw należy obliczyć zawartą w nim masę substancji rozpuszczonej (bezwodnego CuSO4͘). W tym celu z zależności:
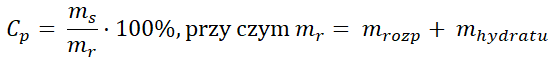
wyznaczamy wielkość ms, stanowiącą wyrażoną w gramach masę substancji rozpuszczonej. W podanym wzorze pozostałe wielkości to:
Cp – stężenie procentowe roztworu,
mr – masa roztworu, na którą składają się: masa hydratu (mhydratu) oraz masa rozpuszczalnika (mrozp, np. wody).
Obliczona w tym przypadku masa substancji rozpuszczonej (bezwodnego CuSO4͘) wynosi 16 g. Wartość tę obliczamy po przekształceniu podanego wyżej wzoru, z którego wyznaczamy wielkość ms. Następnie liczymy, w jakiej masie hydratu znajduje się 16 g soli bezwodnej:
w masie mola hydratu 250 g ———- masa mola soli bezwodnej 160 g
zatem w X gramach hydratu ———- 16 g soli bezwodnej
Z rozwiązania powyższej proporcji uzyskujemy wynik X = 25 g. Tę masę hydratu odważamy na szkiełku zegarkowym i przesypujemy do zlewki. Następnie, w cylindrze miarowym odmierzamy 225 cm3 wody destylowanej. Objętość ta odpowiada masie wody stanowiącej różnicę między masą roztworu (250 g), a policzoną masą hydratu (25 g). Zawartość tego naczynia przelewamy do zlewki zawierającej przygotowaną odważkę hydratu i mieszamy za pomocą bagietki. Na rysunku poniżej przedstawiono szkło laboratoryjne, jakie należy wykorzystać, w celu sporządzenia roztworu o określonym stężeniu procentowym według wyżej opisanych procedur:
Na koniec warto zapamiętać jest pewną prawidłowość:
W tej samej temperaturze nasycone roztwory wodne uzyskane w wyniku rozpuszczenia hydratu lub jego soli bezwodnej charakteryzują się identyczną wartością stężenia procentowego.
Stężenie molowe substancji rozpuszczonej
Stężenie molowe roztworu substancji określa się jako liczbę moli tej substancji, jaka znajduje się w 1 dm3 roztworu. Na przykład, jeśli mówimy o roztworze glukozy, którego stężenie równe jest 0,5 mol·dm–3, oznacza to, że w 1 dm3 takiego roztworu znajduje się 0,5 mola cukru, czyli 90 g. Załóżmy teraz, że naszym celem jest przygotowanie 250 cm3 roztworu glukozy o stężeniu 0,2 mol·dm–3. Aby sporządzić taki układ, najpierw należy obliczyć zawartą w nim masę substancji rozpuszczonej (glukozy). W tym celu ze zmodyfikowanego nieco wzoru opisującego stężenie molowe:
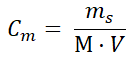
wyznaczamy wielkość ms, stanowiącą wyrażoną w gramach masę tego monosacharydu. W podanym wzorze pozostałe wielkości to:
Cm – stężenie molowe docelowego roztworu [mol·dm–3],
M – masa molowa substancji rozpuszczonej [g∙mol–1],
V – objętość (docelowego) roztworu [dm3].
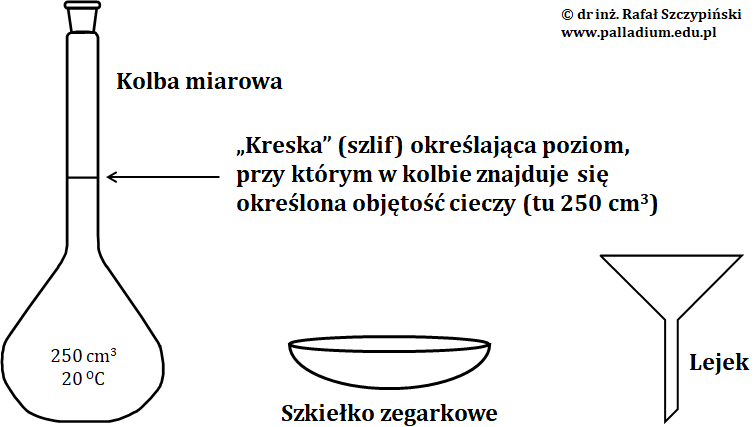
Obliczona w tym przypadku masa glukozy (substancji rozpuszczonej) wynosi 9 g. Wartość tę obliczamy po przekształceniu podanego wyżej wzoru, z którego wyznaczamy wielkość ms. Ilość tę odważamy na szkiełku zegarkowym i przesypujemy do kolby miarowej o pojemności 250 cm3. Podaną pojemność naczynia określa wyszlifowana na jego szyjce kreska. W celu rozpuszczenia glukozy, do kolby dolewamy nieco wody destylowanej i dokładnie mieszamy. Następnie uzupełniamy roztwór wodą destylowaną „do kreski”, uzyskując w ten sposób docelową objętość roztworu cukru o stężeniu równym 0,2 mol·dm–3.
Nieco inaczej przedstawia się sytuacja, gdy dysponujemy hydratem danej soli. Załóżmy teraz, że naszym celem jest przygotowanie 250 cm3 roztworu chlorku żelaza(III) o stężeniu 0,2 mol·dm–3, jeśli dysponujemy jego sześciowodnym hydratem o wzorze sumarycznym FeCl3 · 6H2O. Aby sporządzić opisany roztwór, najpierw należy obliczyć zawartą w nim masę substancji rozpuszczonej (bezwodnego FeCl3). W tym celu ze wzoru:
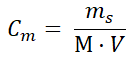
wyznaczamy wielkość ms, stanowiącą wyrażoną w gramach masę substancji rozpuszczonej. Obliczona w tym przypadku masa bezwodnego FeCl3 równa jest 8,125 g. Wartość tę obliczamy po przekształceniu podanego wyżej wzoru, z którego wyznaczamy wielkość ms. Następnie liczymy, w jakiej masie hydratu znajduje się 8,125 g soli bezwodnej:
w masie mola hydratu 270,5 g ———- masa mola soli bezwodnej 162,5 g
zatem w X gramach hydratu ———- 8,125 g soli bezwodnej
Z rozwiązania powyższej proporcji uzyskujemy wynik X = 13,525 g. Taką właśnie masę hydratu odważamy na szkiełku zegarkowym, a następnie przesypujemy do kolby miarowej o pojemności 250 cm3. W celu rozpuszczenia hydratu, do kolby dolewamy nieco wody destylowanej i dokładnie mieszamy. Następnie uzupełniamy roztwór wodą destylowaną „do kreski”, uzyskując w ten sposób docelową objętość roztworu chlorku żelaza(III) o stężeniu molowym 0,2 mol·dm–3. Na rysunku poniżej przedstawiono szkło laboratoryjne, jakiego należy użyć, celem sporządzenia roztworu o określonym stężeniu molowym według wyżej opisanych procedur.
Stężenie masowe substancji rozpuszczonej
Stężenie masowe definiuje się jako masę substancji rozpuszczonej, jaka przypada na określoną jednostkę objętości roztworu. Jednostką takiego stężenia może być na przykład g·dm–3, czy mg·ml–1. Jeśli stężenie sacharozy (cukier trzcinowy) wynosi 15 g·dm–3, oznacza to, że w 1 dm3 roztworu znajduje się (po rozpuszczeniu) 15 g tej substancji.
Załóżmy, że chcemy przygotować 200 cm3 opisanego roztworu sacharozy. Najpierw obliczamy niezbędną ilość cukru, jaką należy odważyć. Rozwiązujemy zatem proporcję:
15 g cukru ———- 1000 cm3 (czyli w 1 dm3 roztworu)
X g cukru ———- 200 cm3
Uzyskujemy wynik X = 3 g. Policzoną masę cukru odważamy na szkiełku zegarkowym i umieszczamy w kolbie miarowej o pojemności 200 cm3. W celu jego rozpuszczenia do kolby dolewamy nieco wody destylowanej i dokładnie mieszamy. Następnie uzupełniamy roztwór wodą destylowaną „do kreski”, uzyskując w ten sposób docelową jego objętość o stężeniu równym 15 g·dm–3.
W przypadku, gdy chcielibyśmy przygotować wodny roztwór Na2CO3 o stężeniu 1 mg·ml–1 i objętości 250 cm3 z wykorzystaniem hydratu o wzorze Na2CO3·10H2O, najpierw musimy określić jaka masa soli bezwodnej będzie znajdować się w docelowym roztworze. W tym celu (pamiętając, że 1 cm3 odpowiada 1 ml) rozwiązujemy proporcję:
0,001 g ———- 1 cm3 (czyli w 1 ml roztworu)
X g Na2CO3 ———- 250 cm3
Uzyskujemy wynik X = 0,25 g soli bezwodnej. Ponieważ dysponujemy jedynie hydratem, należy policzyć w jakiej jego masie znajduje się 0,25 g Na2CO3:
106 g Na2CO3 ———- 286 g dziesięciowodnego hydratu
0,25 g Na2CO3 ———- X g Na2CO3·10H2O
Obliczoną masę X = 0,67 g Na2CO3·10H2O odważamy na szkiełku zegarkowym i umieszczamy w kolbie miarowej o pojemności 250 cm3. W celu rozpuszczenia soli, do kolby dolewamy nieco wody destylowanej i dokładnie mieszamy. Następnie uzupełniamy roztwór wodą destylowaną „do kreski”, uzyskując w ten sposób docelową jego objętość o stężeniu równym 1 mg·ml–1.
Warto zaznaczyć, że szkło laboratoryjne użyte do sporządzenia dwóch wyżej wymienionych roztworów jest takie samo, jak w przypadku sporządzania roztworów o określonym stężeniu molowym.
Na koniec zapraszam Cię do rozwiązania kilku zadań dotyczących omówionych wyżej zagadnień: zadanie 1, zadanie 2, zadanie 3, zadanie 4, zadanie 5, zadanie 6, zadanie 7.
Chcesz wiedzieć więcej na temat sporządzania roztworów wodnych? Projektowanie doświadczeń chemicznych szczegółowo opisałem w podręczniku pt. „Projektowanie doświadczeń chemicznych. Dla maturzystów i nie tylko”. Informacje o książce znajdziesz tutaj.
Spodobał Ci się ten artykuł? Polub mój fanpage na Facebooku oraz na Instagramie, aby nie ominęły Cię żadne nowości.
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone