02.07.2021 | 0 komentarze

Z pewnością nie raz zdarzyło ci się obserwować tzw. oczka tłuszczu pływające na powierzchni zupy, albo plamę oleju silnikowego unoszącą się na kałuży. Z kolei cukier wprowadzony do herbaty „znika” rozpuszczając się w tym słomkowej barwy napoju. Co w takim razie sprawia, że jedne substancje chemiczne o budowie kowalencyjnej łatwo mieszają się z cieczami, a inne tworzą odrębną fazę ciekłą lub stałą? Istotna jest tutaj zdolność do tworzenia przez ich cząsteczki pewnych rodzajów oddziaływań z innymi cząsteczkami… Zacznijmy zatem od krótkiego przeglądu rodzajów oddziaływań międzycząsteczkowych.
Pierwszą myślą, jaka pojawiła się w twojej głowie jest prawdopodobnie wiązanie wodorowe (oddziaływanie wodorowe, lub inaczej – mostek wodorowy).
Jest to oddziaływanie między atomem wodoru – połączonym wiązaniem kowalencyjnym spolaryzowanym z silnie elektroujemnym atomem pierwiastka chemicznego (azotu, tlenu, fluoru) z jednej cząsteczki, a atomem pierwiastka o wysokiej elektroujemności (azot, tlen, fluor), zawierającym co najmniej jedną wolną parę elektronową w drugiej cząsteczce.
Aby takie oddziaływanie mogło się pojawić, muszą zostać spełnione jednocześnie pewne trzy warunki:
1. Obecność atomu silnie elektroujemnego pierwiastka chemicznego (azot, tlen, fluor) w każdej z cząsteczek.
2. W pierwszej z cząsteczek pierwiastek ten (azot, tlen, fluor) musi być połączony wiązaniem kowalencyjnym spolaryzowanym z atomem wodoru. Wymieniony atom w tej cząsteczce będzie wówczas donorem wiązania wodorowego.
3. W drugiej z cząsteczek pierwiastek ten (azot, tlen, fluor) musi mieć co najmniej jedną wolną parę elektronową. Wymieniony atom w tej cząsteczce będzie wtedy akceptorem wiązania wodorowego).
Na rysunkach wiązania wodorowe zaznaczamy schematycznie linią przerywaną:
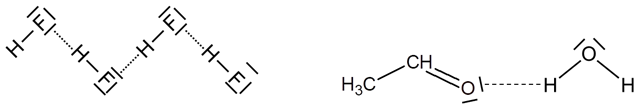
Więcej o wiązaniach wodorowych przeczytasz w tym artykule.
Innym oddziaływaniem międzycząsteczkowym jest oddziaływanie typu dipol-dipol – które jak nazwa wskazuje – pojawia się między dwiema cząsteczkami o budowie polarnej. Oznacza to, że w takiej drobinie możemy wyróżnić biegun dodatni oraz biegun ujemny. Dzięki ich obecności cząsteczki polarne przyciągają się, na przykład według schematu:
Siły Londona.
Powstają w wyniku chwilowego przemieszczenia się chmury elektronowej atomów oraz cząsteczek. W rezultacie jeden obszar cząsteczki (lub atomu) uzyskuje chwilowy ładunek ujemny, a drugi obszar – chwilowy ładunek dodatni. Taki nierównomierny rozkład ładunku jest przyczyną powstania chwilowego momentu dipolowego.
Są to oddziaływania przyciągające, jakie występują między elektrycznie obojętnymi drobinami niezależnie od ich polarności, w tym również w gazach szlachetnych. Siły Londona zwiększają się wraz ze wzrostem liczby elektronów w cząsteczce, a zatem również z masą molową pierwiastka czy związku chemicznego. Obserwujemy wtedy częstsze zmiany położenia chmury elektronowej.
Gdy znasz już podstawowe oddziaływania międzycząsteczkowe, spróbujmy teraz odpowiedzieć na postawione na początku artykułu pytanie. W szkole wielokrotnie powtarza się, że „podobne rozpuszcza podobne”. Pomyślmy, dlaczego tak się dzieje. Między cząsteczkami substancji kowalencyjnych tworzą się wymienione wyżej oddziaływania, przy czym nie zawsze wszystkie z nich występują jednocześnie. Ponadto niektóre z oddziaływań są bardziej dominujące, co oznacza, że mają większy udział niż pozostałe.
Aby określić możliwość rozpuszczenia substancji kowalencyjnej (na przykład cukru) w wodzie, należy rozważyć rodzaj dominujących oddziaływań między cząsteczkami rozpuszczalnika oraz rodzaj dominujących oddziaływań między cząsteczkami rozpuszczanej substancji. Takie oddziaływania mogą być wówczas zastąpione identycznymi oddziaływaniami, utworzonymi pomiędzy cząsteczkami substancji rozpuszczonej i cząsteczkami rozpuszczalnika.
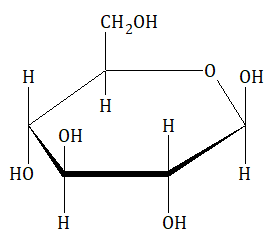
Cząsteczki wody mają budowę polarną oraz wykazują zdolność do tworzenia wiązań wodorowych. W przedstawionym przypadku, dominującymi oddziaływaniami (oprócz oddziaływania dipol-dipol) są również wiązania wodorowe. Aby dana substancja była dobrze rozpuszczalna w wodzie, pomiędzy jej cząsteczkami, a cząsteczkami tego rozpuszczalnika powinny tworzyć się zatem dwa wymienione typy oddziaływań. Bardzo dobrym przykładem jest monosacharyd o nazwie glukoza. Wzór cząsteczki tego cukru prostego stanowiącego jeden z jego stereoizomerów (anomer β), który dominuje w jego wodnym roztworze przedstawia rysunek:
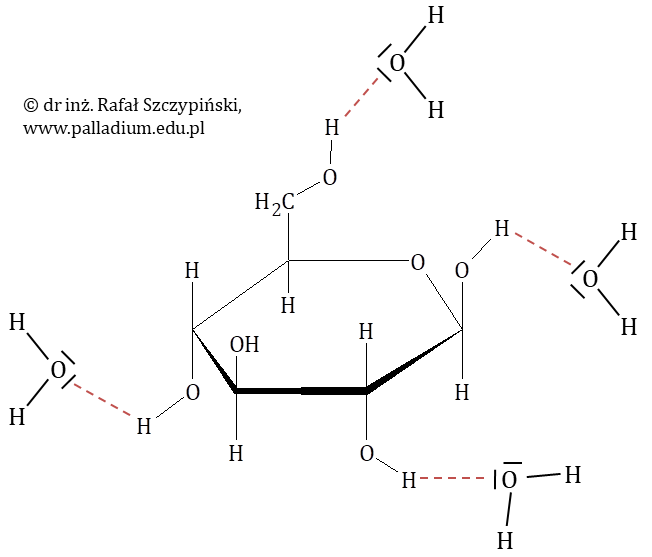
Swoją bardzo dobrą rozpuszczalność w wodzie glukoza zawdzięcza obecności grup hydroksylowych (–OH) w cząsteczce. Za pośrednictwem tych ugrupowań tworzy z cząsteczkami wody silne wiązania wodorowe. Oddziaływania te tworzą się „w zastępstwie” wiązań wodorowych, jakie występują pomiędzy cząsteczkami wody, co schematycznie przedstawia rysunek, na którym (w celu zwiększenia czytelności) pominięte zostały wolne pary elektronowych atomów tlenu w cząsteczce glukozy:
W przypadku substancji, które nie mają budowy polarnej (na przykład bromu – Br2) będziemy mówić o ich dobrej rozpuszczalności w rozpuszczalnikach niepolarnych (czterochlorek węgla – CCl4), lub o niewielkiej polarności (chloroform – CHCl3). W tym przypadku również będziemy kierować się zasadą, zgodnie z którą rozważa się zastępowanie podobnych oddziaływań, jakie występują między cząsteczkami rozpuszczalnika oraz cząsteczkami substancji rozpuszczanej. W rozważanej sytuacji z bromem będą to wówczas głównie siły Londona (siły dyspersyjne), jakie tworzą się w następstwie pojawienia dipoli indukowanych.
Potwierdzeniem powyższych rozważań jest również obserwowany spadek rozpuszczalności w wodzie wraz ze wzrostem długości łańcucha węglowego wielu związków organicznych zawierających ugrupowania polarne. Za przykład niech posłużą dwa kwasy karboksylowe – octowy (CH3COOH) oraz stearynowy (C17H35COOH). Pierwszy z wymienionych związków chemicznych w temperaturze 25 oC w zasadzie nieograniczenie miesza się z wodą, natomiast kwas stearynowy jest w niej praktycznie nierozpuszczalny. Dlaczego tak się dzieje? Otóż wraz ze wzrostem długości łańcucha węglowego zwiększa się udział oddziaływań jakimi są siły Londona, a maleje zdolność do tworzenia się wiązań wodorowych między cząsteczkami. Siły Londona nie mogą zostać zastąpione wiązaniami wodorowymi, stąd kwas stearynowy pomimo obecnej w jego cząsteczce polarnej grupy karboksylowej (–COOH) praktycznie nie rozpuszcza się w wodzie…
Na koniec zastanów się, dlaczego narzędzi (pędzli, lub wałków) użytych do malowania tzw. farbami ftalowymi nie uda się wyczyścić wodą, natomiast te same narzędzia wykorzystane do malowania farbami akrylowymi nie mogą zostać umyte za pomocą benzyny lakowej stanowiącej mieszaninę węglowodorów.
Spodobał Ci się ten artykuł? Polub mój fanpage na Facebooku oraz na Instagramie, aby nie ominęły Cię żadne nowości.
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone