03.11.2019 | 2 komentarze

Pomysł napisania poniższego artykułu zrodził się po przeczytaniu licznych dyskusji prowadzonych w tematycznych grupach Facebooka. W miarę zwięźle, prostym, aczkolwiek chemicznym językiem postaram się wyjaśnić pewne związane z izomerią geometryczną niedopowiedzenia wskazując na to, co obowiązuje Cię do matury z chemii oraz na to, co może pojawić się z tekstem wprowadzającym na tym egzaminie.
Izomeria geometryczna typu E-Z oraz cis–trans
Na początek przypomnijmy sobie, kiedy organiczny związek łańcuchowy ma izomery geometryczne?
Organiczny związek chemiczny o budowie łańcuchowej ma izomery geometryczne, jeśli w jego cząsteczce do każdego z atomów węgla połączonych wiązaniem podwójnym przyłączone są dwa różne podstawniki.
Jako przykłady niech posłużą schematycznie narysowane poniższe trzy wzory cząsteczek, w których literami X, Y, Z oraz W oznaczono atom wodoru lub symbol innego pierwiastka chemicznego/ugrupowania atomów, przy czym X ≠ Y ≠ Z ≠ W (znak ≠ oznacza „różny od”).
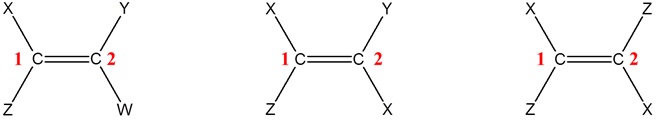
Zwróć uwagę, że każdy z oznaczonych cyframi 1 i 2 atomów węgla połączony jest z dwoma różnymi podstawnikami. Są to zatem cząsteczki spełniające warunek, aby można było zaliczyć je do izomerów geometrycznych.
Przypisanie ważności podstawników jest istotnym etapem podczas nadawania nazwy systematycznej izomerom geometrycznym typu E-Z oraz optycznym (R, S – o nich w dalszej części tekstu) związków organicznych. Dzięki temu jednoznacznie możemy wskazać właściwy wśród takich stereoizomerów.
W przypadku alkenów, czy też innych związków organicznych zawierających pomiędzy atomami węgla wiązanie podwójne rozważa się podstawniki połączone z tymi właśnie atomami węgla. Rysunek poniżej przedstawia wzór cząsteczki izomeru geometrycznego pewnego alkenu ze wskazaniem ugrupowań atomów, które brane są pod uwagę podczas ustalania ważności podstawników. W narysowanej cząsteczce niebieskim oraz zielonym polem zaznaczono pary podstawników, których ważność jest rozważana.
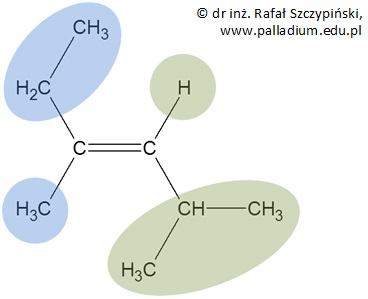
W przedstawionym przypadku, jako pierwszą parę rozpatruje się grupy: metylową oraz etylową – obie zaznaczone są niebieskim tłem. Drugą rozważaną parą są atom wodoru oraz grupa izopropylowa – tło zielone. W wymienionych parach ważniejsze są:
Para nr 1: grupa etylowa niż metylowa,
Para nr 2: grupa izopropylowa niż atom wodoru.
Ważność podstawników ustaliliśmy stosując tzw. reguły Cahna-Ingolda-Preloga, według schematu postępowania:
1. W cząsteczce związku chemicznego zawierającej wiązanie podwójne pomiędzy atomami węgla, pierwszeństwo ważności ma ten podstawnik, którego atom połączony bezpośrednio z danym atomem węgla wiązania podwójnego ma większą wartość liczby atomowej.
2. W przypadku, gdy porównywane pierwiastki są takie same, to wówczas rozważamy bezpośrednio połączone z nimi kolejne pierwiastki według reguły pierwszeństwa z punktu 1.
3. Opisaną procedurę kontynuujemy aż do skutku, tzn. do momentu, gdy trafimy na pierwiastek o największej (wśród kolejno porównywanych) liczbie atomowej.
W przedstawionym przypadku mamy do czynienia z tzw. izomerem geometrycznym typu E (niem. entgegen, czyli naprzeciw), ponieważ ważniejsze podstawniki (szare pola na rysunku poniżej) przyłączone do atomów węgla połączonych wiązaniem podwójnym ułożone są po przeciwnych stronach płaszczyzny, na której leży wiązanie podwójne:
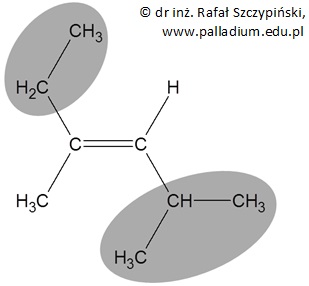
Jest to zatem węglowodór o nazwie (3E)-2,4-dimetyloheks-3-en.
Z kolei z izomerem geometrycznym typu Z (niem. zusammen, czyli razem) mamy do czynienia, gdy ważniejsze podstawniki (szare pola na rysunku poniżej) przyłączone do atomów węgla połączonych wiązaniem podwójnym ułożone są po tej samej stronie płaszczyzny, na której leży wiązanie podwójne:
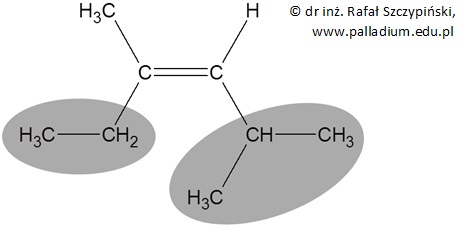
Jest to zatem węglowodór o nazwie (3Z)-2,4-dimetyloheks-3-en.
Proste, prawda? Oczywiście, że tak. W takim razie spróbujmy z czymś nieco bardziej złożonym. Określmy ważność podstawników zaznaczonych czerwonym polem w takiej halogenopochodnej alkenu:
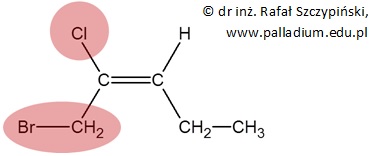
Atom chloru ma większą wartość liczby atomowej, niż atom węgla (w grupie –CH2Br), zatem chlor jest podstawnikiem ważniejszym, niż grupa –CH2Br, nawet jeśli atom węgla połączony jest z atomem bromu, który ma liczbę atomową większą od liczby atomowej chloru.
W zastosowanej tu regule Cahna-Ingolda-Preloga (punkt 1) nie chodzi o wagę podstawnika w sensie masy, lecz o wagę w rozumieniu ważność (istotność). Porównaj to ze stwierdzeniem „sprawa najwyższej wagi”, które oznacza sprawę najbardziej istotną, a nie o największej masie… Dla formalności nadajmy jeszcze nazwę cząsteczce narysowanego związku chemicznego, która brzmi (2E)-1-bromo-2-chloropent-2-en.
Wzajemne ułożenie ważniejszych podstawników dotyczy izomerii geometrycznej typu E-Z, której znajomość nie jest wymagana do egzaminu maturalnego z chemii bez stosownego tekstu wstępnego. Ten typ izomerii bardzo często mylony jest z izomerią geometryczną typu cis-trans, a warunek konieczny występowania obu wymienionych typów izomerii jest taki sam i wymieniony został na początku tego artykułu.
Z izomerem geometrycznym typu cis mamy do czynienia, gdy dwa takie same podstawniki (pomarańczowe pola) przyłączone do atomów węgla połączonych wiązaniem podwójnym ułożone są po tej samej stronie płaszczyzny na której leży wiązanie podwójne:
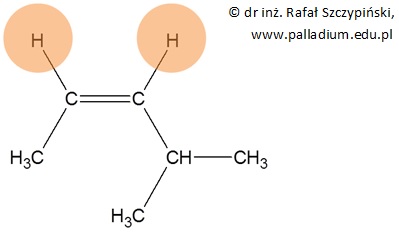
Jest to zatem węglowodór o nazwie cis-4-metylopent-2-en.
Zwróć uwagę, że narysowana w powyższym przykładzie cząsteczka jest jednocześnie izomerem geometrycznym typu Z.
Z izomerem geometrycznym typu trans mamy do czynienia, gdy dwa takie same podstawniki (pomarańczowe pola) przyłączone do atomów węgla połączonych wiązaniem podwójnym ułożone są po przeciwnych stronach płaszczyzny na której leży wiązanie podwójne:
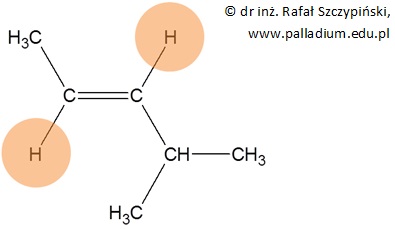
Jest to zatem węglowodór o nazwie trans-4-metylopent-2-en.
Zwróć uwagę, że narysowana w powyższym przykładzie cząsteczka jest jednocześnie izomerem geometrycznym typu E.
UWAGA:
Na maturze nie ma obowiązku stosowania przyjętych przez IUPAC oznaczeń E oraz Z izomerów geometrycznych, których odpowiednikami (w niektórych przypadkach) są odpowiednio zwroty trans oraz cis.
W zadaniach maturalnych spotkasz się z przykładami, w których jednoznaczne możliwe będzie przypisanie odpowiedniego izomeru geometrycznego cis lub trans.
Izomeria optyczna
W przypadku związków organicznych wykazujących czynność optyczną określamy ważność podstawników połączonych z centrum stereogenicznym cząsteczki. Centrum takie stanowi tzw. asymetryczny atom węgla i umownie oznacza się go gwiazdką (*). Również w tym przypadku stosuje się reguły Cahna-Ingolda-Preloga. Na przykład:
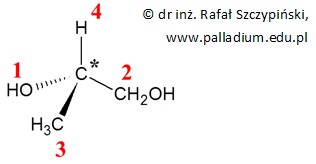
Najważniejszym podstawnikiem jest grupa hydroksylowa –OH, ponieważ atom tlenu ma większą wartość liczby atomowej, niż atomy węgla z grup –CH3 oraz –CH2OH. Z kolei grupa –CH2OH jest ważniejsza, niż grupa –CH3, ponieważ należący do niej atom węgla połączony jest z atomem tlenu, który ma większą wartość liczby atomowej od liczby atomowej wodoru (którego atomy należą do grupy –CH3).
W przypadku związków czynnych optycznie, reguła pierwszeństwa podstawników ma zastosowanie w określaniu konfiguracji absolutnej stereoizomeru. Na przykład narysowany wyżej wzór cząsteczki alkoholu jest izomerem o konfiguracji absolutnej S (łac. sinister, czyli lewy) centrum stereogenicznego, a izomer ten ma nazwę (2S)-propano-1,2-diol.
Przypisywanie konfiguracji absolutnej danej cząsteczce oraz nadawanie jej nazwy z uwzględnieniem tej konfiguracji nie jest wymagane na egzaminie maturalnym z chemii. Pamiętaj jednak, że dzięki znajomości tego zagadnienia możliwa jest ocena, który ze wzorów przedstawia tę samą cząsteczkę, ale inaczej narysowaną, a to już w programie matury jest obowiązkowe… W kolejnym artykule przybliżę to zagadnienie, a tymczasem zapraszam Cię do rozwiązania kilku związanych z izomerią geometryczną zadań:
zadanie 1, zadanie 2, zadanie 3, zadanie 4, zadanie 5, zadanie 6, zadanie 7, zadanie 8.
Spodobał Ci się ten artykuł? Polub mój fanpage na Facebooku oraz na Instagramie, aby nie ominęły Cię żadne nowości.
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Czy aby wystąpiła izomeria Cis Trans tym samym podstawnikiem musi być konkretnie atom wodoru czy mogą to być inne identyczne podstawniki?
Każdy z atomów węgla połączonych wiązaniem podwójnym musi koniecznie łączyć się z atomem wodoru.