22.08.2019 | 0 komentarze

Dziś opowiemy sobie nieco na temat reguły mieszania roztworów, znanej również pod nazwą „krzyżaka”. Regułę tę stosujemy w następujących przypadkach:
– mieszanie roztworów tej samej substancji, ale o różnych stężeniach,
– dolewanie rozpuszczalnika (rozcieńczanie),
– odparowywanie rozpuszczalnika (zatężanie),
– dosypywanie substancji bezwodnej (zatężanie),
– dosypywanie hydratu.
UWAGA:
Reguły mieszania roztworów nie stosuje się w przypadku mieszania roztworów różnych substancji ! ! !
Schemat reguły krzyżowej („krzyżaka”) ilustruje rysunek poniżej:
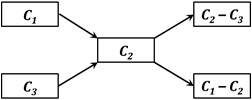
Wyrażenia w prostokątach oznaczają:
C1, C3 – stężenia roztworów, które są ze sobą mieszane, C2 – stężenie roztworu docelowego (powstałego w wyniku zmieszania roztworów C1 oraz C3). Dla podanych oznaczeń konieczne jest zatem założenie:
C1 > C2 > C3.
Zależności, jakie uzyskujemy po zastosowaniu algorytmu w przypadku stężenia procentowego oznaczają kolejno:
liczbę równą C2 – C3 części wagowych roztworu o stężeniu C1, jakie trzeba zmieszać z C1 – C2 częściami wagowymi roztworu o stężeniu C3, aby uzyskać roztwór o stężeniu C2.
Wykorzystując algorytm w obliczeniach z udziałem stężeń molowych, zawarte w nim wyrażenia oznaczają wówczas:
liczbę równą C2 – C3 części objętościowych roztworu o stężeniu C1, jakie trzeba zmieszać z C1 – C2 częściami objętościowymi roztworu o stężeniu C3, aby uzyskać roztwór o stężeniu C2.
W tabeli poniżej przedstawiono wyrażenia wynikające z zastosowania opisanej wyżej reguły mieszania roztworów.
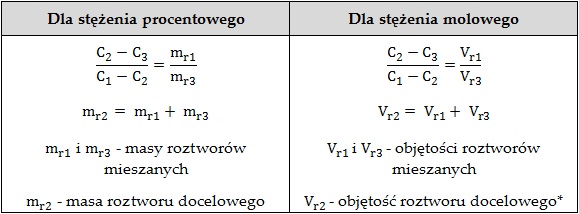
* Przy założeniu, że objętość roztworu docelowego jest sumą objętości roztworów mieszanych, zatem pomijane jest zjawisko kontrakcji.
Przykładowe zadania dotyczące mieszania roztworów tej samej substancji zebrane zostały tutaj: zadanie 1, zadanie 2, zadanie 3.
Regułę mieszania roztworów można zastosować również do rozwiązywania zadań związanych z rozcieńczaniem. Na przykład, jeśli rozcieńczamy roztwór C1 dolewając do niego rozpuszczalnik C3 (np. wodę), to wówczas rozpuszczalnik ten traktujemy jak roztwór najbardziej rozcieńczony, czyli 0% (stężenie procentowe) lub 0 mol∙dm-3 (stężenie molowe) – a zatem niezawierający substancji rozpuszczonej.
UWAGA: rozcieńczanie roztworów mocnych kwasów (na przykład siarkowego(VI)) należy wykonywać z zachowaniem szczególnej ostrożności. Dochodzi wtedy do wydzielenia się bardzo dużych ilości energii na sposób ciepła, co może doprowadzić nawet do wrzenia znajdującej się w naczyniu mieszaniny. Stężone roztwory kwasów mają gęstość dużo większą od gęstości wody destylowanej, stąd, gdyby wlewać wodę do kwasu, wówczas mieszanie obu tych substancji przebiegałoby na powierzchni cieczy. W konsekwencji wrzący w tym obszarze roztwór ulegałby rozpryskowi w kierunku, który stawia najmniejszy opór podczas przemieszczania się kwasu, czyli w stronę wylotu z naczynia. Aby uniknąć tego rodzaju zdarzeń stosuje się zasadę, według której to kwas wlewa się do wody, a nie odwrotnie. Kwas, jako substancja o większej niż woda gęstości opada wówczas na dno naczynia i w obszarze tym dochodzi do jego mieszania się z rozpuszczalnikiem (wodą).
![]()
Kilka zadań dotyczących rozcieńczania roztworów zebranych zostało tutaj: zadanie 1, zadanie 2, zadanie 3, zadanie 4.
Regułę mieszania można zastosować również w obliczeniach dotyczących zatężania roztworów. Z zatężaniem roztworu mamy do czynienia każdorazowo, gdy wzrasta jego stężenie, a dokładniej – zwiększa się udział wagowy substancji rozpuszczonej w stosunku do masy rozpuszczalnika. Ma to miejsce wtedy, gdy do roztworu dodaje się kolejne porcje substancji, albo odparowuje z niego rozpuszczalnik. W pierwszym przypadku, dosypywaną substancję traktujemy jak roztwór o maksymalnym stężeniu, równym 100%. Założenie takie stosujemy wówczas wyłącznie dla stężenia procentowego. Przykładowe zadania związane z zatężaniem roztworów na drodze posypywania substancji rozpuszczonej oraz odparowania rozpuszczalnika zebrane zostały tutaj: zadanie 1, zadanie 2, zadanie 3, zadanie 4, zadanie 5.
W przypadku stężeń procentowych, reguła mieszania roztworów pozwala również stosunkowo szybko rozwiązywać zadania dotyczące sytuacji, gdy do sporządzenia roztworu soli stosuje się jej hydrat. Przyjmujemy wówczas, że hydrat jest roztworem o stężeniu procentowym równym zawartości procentowej (procencie wagowym) soli bezwodnej w hydracie. Na przykład, gdy mówimy o związku chemicznym CuSO4∙5H2O (o masie mola 250 g), wówczas mamy na myśli „stężenie procentowe” CuSO4 (o masie mola 160 g) w hydracie równe 64%. Kilka związanych z tym zagadnieniem zadań znajdziesz pod linkami: zadanie 1, zadanie 2, zadanie 3.
Mam nadzieję, że po tej lekturze mieszanie roztworów przestanie sprawiać Ci problemy 🙂
UWAGA: podane przykłady nie są „jedyną słuszną” metodą rozwiązywania zadań dotyczących zmiany stężeń roztworów, aczkolwiek ułatwiają poruszanie się w obrębie tego zagadnienia. Pamiętaj, że każda zawierająca poprawny tok rozumowania metoda rozwiązania zadania uznawana jest na egzaminie maturalnym z chemii.
Artykuł opracowano na podstawie podręcznika „Projektowanie doświadczeń chemicznych. Dla maturzystów i nie tylko”.
Spodobał Ci się ten artykuł? Polub mój fanpage na Facebooku oraz na Instagramie, aby nie ominęły Cię żadne nowości.
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone