05.01.2020 | 0 komentarze

Miareczkowanie jest metodą stosowaną do ilościowego oznaczania zawartości substancji chemicznej w jej wodnym roztworze. Podczas jego wykonywania, do roztworu analitu o znanej objętości, lecz nieznanym stężeniu ostrożnie wprowadza się znajdujący w biurecie mianowany (o ściśle określonym stężeniu) roztwór titranta, co schematycznie ilustruje rysunek poniżej.
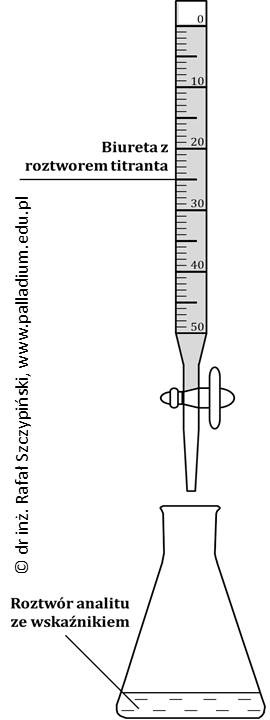
Istnieje kilka rodzajów miareczkowania: alkacymetria, redoksymetria, kompleksometria oraz metody strąceniowe. W artykule skupimy się jedynie na miareczkowaniu alkacymetrycznym, podczas którego zmianom ulega pH oznaczanego roztworu kwasu lub zasady. Czynność tę prowadzi się w obecności wskaźnika alkacymetrycznego – substancji, która zmienia swoją barwę w zależności od wartości pH roztworu w jakim się znajduje. Dobór odpowiedniego wskaźnika omówiony został w dalszej części tego opracowania. Charakterystyczny podczas miareczkowania jest moment, zwany punktem równoważnikowym (PR).
PUNKTEM RÓWNOWAŻNIKOWYM miareczkowania nazywamy moment, w którym analit przereagował ilościowo z dodanym z biurety titrantem.
Po osiągnięciu punktu równoważnikowego odczytuje się objętość zużytego do tej chwili roztworu mianowanego. Następnie, uwzględniając jego stężenie oraz stechiometrię przebiegającej reakcji chemicznej, oblicza się zawartość substancji oznaczanej w roztworze.
Przebieg krzywych miareczkowania.
Wspomniane zmiany pH analizowanego roztworu rejestruje się każdorazowo, po wprowadzeniu do niego określonej porcji titranta. Na podstawie uzyskanych w ten sposób danych doświadczalnych sporządzany jest wykres obrazujący zmiany pH analizowanego roztworu w zależności od objętości dodawanego do niego roztworu titranta. Wykres taki nazywa się krzywą miareczkowania, a charakterystyczną jej cechą jest skok wartości pH w okolicach punktu równoważnikowego. Cztery kolejne zamieszczone poniżej rysunki dotyczą miareczkowania z udziałem roztworów jednoprotonowych kwasów.
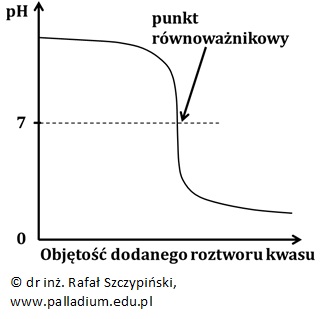
Punkt równoważnikowy odpowiada wartości pH równej 7, jeśli miareczkuje się:
– roztwór mocnej zasady roztworem mocnego kwasu,
– roztwór mocnego kwasu roztworem mocnej zasady.
Rysunek poniżej ilustruje poglądowy przebieg krzywej miareczkowania podczas miareczkowania roztworu mocnej zasady roztworem mocnego kwasu:
 W przypadku miareczkowania roztworu mocnego kwasu roztworem mocnej zasady przebieg krzywej można zilustrować w następującej postaci:
W przypadku miareczkowania roztworu mocnego kwasu roztworem mocnej zasady przebieg krzywej można zilustrować w następującej postaci:
Nieco inaczej wygląda przebieg tych krzywych w przypadku miareczkowania roztworu słabej zasady roztworem mocnego kwasu.
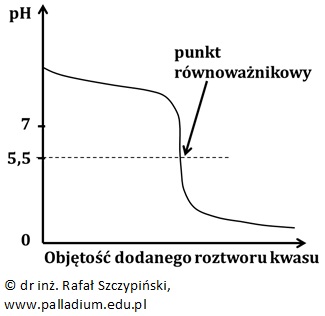
Punkt równoważnikowy odpowiada wartości pH < 7, jeśli miareczkuje się roztwór słabej zasady roztworem mocnego kwasu. Dla wartości pH odpowiadającej punktowi równoważnikowemu uzyskuje się wówczas roztwór soli pochodzącej od mocnego kwasu i słabej zasady, w którym przebiega proces hydrolizy kationowej.
Schemat przebiegu krzywej miareczkowania ilustruje wówczas rysunek:
Z kolei:
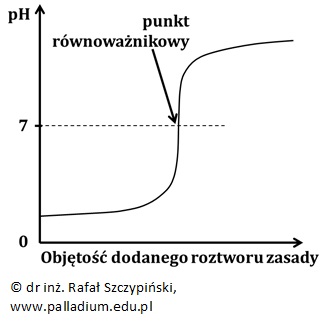
Punkt równoważnikowy odpowiada wartości pH > 7, jeśli miareczkuje się roztwór słabego kwasu roztworem mocnej zasady. Dla wartości pH odpowiadającej punktowi równoważnikowemu uzyskuje się wówczas roztwór soli pochodzącej od słabego kwasu i mocnej zasady, w którym przebiega proces hydrolizy anionowej.
Krzywa miareczkowania przyjmuje wówczas następującą postać:
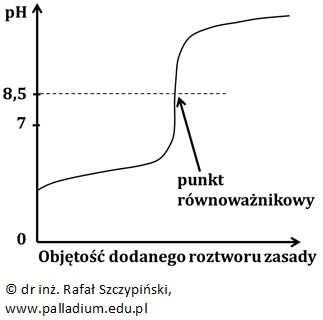
Zaznaczone na dwóch ostatnich wykresach wartości pH punktów równoważnikowych (odpowiednio 5,5 oraz 8,5) mają jedynie charakter poglądowy. Ich dokładne wartości pH zależą nie tylko od stężenia, ale przede wszystkim – od rodzaju słabego kwasu (lub zasady), których wodne roztwory soli uzyskuje się w punkcie równoważnikowym miareczkowania.
Dobór wskaźnika alkacymetrycznego.
Jeśli roztwory obu reagujących substancji – titranta i analitu – są bezbarwne, wówczas istnieje konieczność zastosowania ściśle określonego wskaźnika alkacymetrycznego (kwasowo-zasadowego). W celu doboru odpowiedniego wskaźnika podczas miareczkowania, najpierw należy oszacować wartość pH odpowiadającą punktowi równoważnikowemu.
Indykator dobieramy tak, aby jego zakres wskaźnikowy obejmował punkt równoważnikowy miareczkowania lub, aby punkt ten leżał możliwie blisko tego zakresu.
Błąd miareczkowania będzie tym mniejszy, im punkt równoważnikowy będzie znajdował się bliżej „środka” zakresu wskaźnikowego. Na przykład, podczas miareczkowania roztworu zawierającego słaby kwas roztworem mocnej zasady PR przypada dla wartości pH > 7, zatem bardzo dobrym wskaźnikiem byłaby wówczas fenoloftaleina, której zakres wskaźnikowy odpowiada wartościom pH z zakresu 8.2 ÷ 10.
To byłoby na tyle, jeśli chodzi o podstawową wiedzę, jaka obowiązuje do matury z zakresu miareczkowania. Zapraszam Cię teraz do sprawdzenia się poprzez rozwiązanie moich autorskich zadań, które dostępne są tutaj.
Spodobał Ci się ten artykuł? Polub mój fanpage na Facebooku oraz na Instagramie, aby nie ominęły Cię żadne nowości.
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone