Zadanie 9.1. Zapis równań reakcji chemicznych. Doświadczenia chemiczne w zadaniach część 1. Rozdział 1 (2 punkty)
Do probówek zawierających roztwór NaOH, wodę destylowaną oraz kwas solny wprowadzono aluminiowe blaszki. Zamieszczona fotografia ilustruje jedno z naczyń, w których zarejestrowano ten sam objaw świadczący o przebiegu reakcji chemicznej.

Napisz w formie jonowej skróconej równania reakcji chemicznych którym towarzyszył ten sam objaw. W trakcie jednej z tych przemian powstaje związek kompleksowy o liczbie koordynacyjnej 4. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 9.2. Wskazanie właściwych piktogramów ostrzegawczych. Doświadczenia chemiczne w zadaniach część 1. Rozdział 1 (1 punkt)
Do probówek zawierających roztwór NaOH, wodę destylowaną oraz kwas solny wprowadzono aluminiowe blaszki. Zamieszczona fotografia ilustruje jedno z naczyń, w których zarejestrowano ten sam objaw świadczący o przebiegu reakcji chemicznej.

Substancja chemiczna odpowiedzialna za widoczny na fotografii objaw przebiegu reakcji chemicznej przechowywana jest w specjalnych naczyniach, które opisuje kilka spośród zamieszczonych piktogramów ostrzegawczych.
Podkreśl te spośród podanych grafik, które opisują substancję o której mowa. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone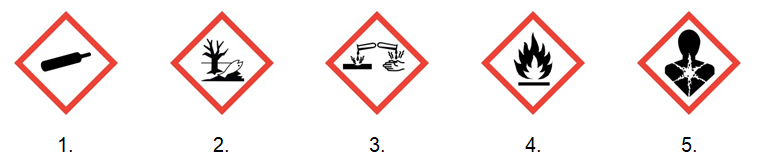
Zadanie 9.3. Ocena poprawności zdań. Doświadczenia chemiczne w zadaniach część 1. Rozdział 1 (1 punkt)
Do probówek zawierających roztwór NaOH, wodę destylowaną oraz kwas solny wprowadzono aluminiowe blaszki. Zamieszczona fotografia ilustruje jedno z naczyń, w których zarejestrowano ten sam objaw świadczący o przebiegu reakcji chemicznej.

Oceń poprawność poniższych zdań dotyczących opisanego doświadczenia chemicznego. Wpisz literę „P” (prawda) lub literę „F” (fałsz). 1. Jedna z przemian biegnących w trakcie opisanego doświadczenia jest przykładem reakcji wymiany pojedynczej. 2. Cząsteczki powstałego produktu gazowego są dipolami elektrycznymi. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 10. Określanie charakteru chemicznego tlenku z uzasadnieniem. Doświadczenia chemiczne w zadaniach część 1. Rozdział 1 (1 punkt)
Jednym ze wskaźników kwasowo-zasadowych jest błękit bromofenolowy. Fotografie 1.–6. Ilustrują wodne roztwory zawierające ten wskaźnik uszeregowane zgodnie ze wrastającym pH od wartości 2 do 13.

Do roztworu znajdującego się w probówce 4., o pH wyższym niż 7 wprowadzono tlenek X pewnego pierwiastka chemicznego w takiej ilości, że uzyskano roztwór widoczny na fotografii 2. Jednocześnie do roztworu widocznego na fotografii 1. wprowadzono ten sam gazowy tlenek, jednak barwa roztworu nie uległa zmianie.
Określ charakter chemiczny tlenku X. Uzasadnij swoje stanowisko. Charakter chemiczny: Uzasadnienie: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 12.1. Wybór właściwej fotografii oraz uzupełnienie schematu reakcji chemicznej. Doświadczenia chemiczne w zadaniach część 1. Rozdział 1 (1 punkt)
Wodą amoniakalną nazywa się wodny roztwór amoniaku. Ulatniająca się z niego substancja gazowa ma drażniący zapach oraz powoduje zmianę barwy papierka wskaźnikowego.
W celu zbadania charakteru chemicznego ulatniającej się z wody amoniakalnej substancji przeprowadzono dwuetapowe doświadczenie chemiczne.
W pierwszym etapie nad wylotem naczynia umieszczono wilgotny uniwersalny papierek wskaźnikowy. Jedna z fotografii (A, B lub C) wykonana została podczas tego etapu eksperymentu:

Spośród powyższych zdjęć wybierz to, które zostało wykonane podczas opisanego doświadczenia. Wpisz wzory sumaryczne odpowiednich drobin (cząsteczek oraz jonów) odpowiadających ich modelom przestrzennym w zamieszczonym poniżej schemacie procesu chemicznego przebiegającego na powierzchni papierka wskaźnikowego z udziałem ulatniającej się substancji. Wybrana fotografia: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone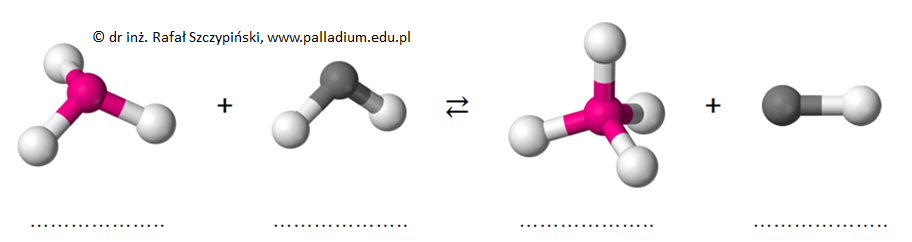
Zadanie 11. Zapis równań reakcji chemicznych oraz określenie charakteru chemicznego tlenku. Doświadczenia chemiczne w zadaniach część 1. Rozdział 1 (2 punkty)
Jednym ze wskaźników kwasowo-zasadowych jest błękit bromofenolowy. Fotografie 1.–6. Ilustrują wodne roztwory zawierające ten wskaźnik uszeregowane zgodnie ze wrastającym pH od wartości 2 do 13.

Zbadano charakter chemiczny jednego z tlenków:
PbO, SiO2, Al2O3, P4O10.
W tym celu przeprowadzono eksperyment podczas którego próbkę badanej substancji o takiej samej masie wprowadzono do dwóch probówek oznaczonych literami A oraz B i energicznie wstrząśnięto. W probówce A znajdował się roztwór kwasu chlorowodorowego o stężeniu jonów chlorkowych 0,1 mol∙dm–3, z dodatkiem błękitu bromofenolowego. W naczyniu B roztwór KOH o takim samym stężeniu molowym jak użyty kwas solny, z tym samym wskaźnikiem alkacymetrycznym. Po zakończeniu doświadczenia w każdym z naczyń znajdował się klarowny roztwór. Zawartość naczynia A przyjęła wówczas barwę identyczną jak w probówce 3., natomiast zawartość naczynia B – taką jak w probówce 5.
Napisz w formie jonowej skróconej równania reakcji chemicznych jakie przebiegły w naczyniach A i B po wprowadzeniu do ich zawartości odpowiedniego tlenku. Określ charakter chemiczny dodanej substancji. A: B: Charakter chemiczny: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 12.2. Zapis równania reakcji chemicznej i określenie charakteru chemicznego. Doświadczenia chemiczne w zadaniach część 1. Rozdział 1 (1 punkt)
Wodą amoniakalną nazywa się wodny roztwór amoniaku. Ulatniająca się z niego substancja gazowa ma drażniący zapach oraz powoduje zmianę barwy papierka wskaźnikowego.
W celu zbadania charakteru chemicznego ulatniającej się z wody amoniakalnej substancji przeprowadzono dwuetapowe doświadczenie chemiczne.
W drugim etapie roztwór z probówki wprowadzono do kwasu solnego zawierającego kilka kropli roztworu błękitu bromotymolowego i zaobserwowano zmianę barwy zawartości naczynia.
Stosując protonową teorię kwasów i zasad Brønsteda, napisz w formie jonowej skróconej równanie reakcji chemicznej jaka przebiegła. Określ charakter chemiczny (kwasowy, zasadowy, obojętny) ulatniającej się z wody amoniakalnej substancji. Równanie reakcji: Charakter chemiczny: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 13. Wybór właściwych piktogramów ostrzegawczych. Doświadczenia chemiczne w zadaniach część 1. Rozdział 1 (1 punkt)
Wodą amoniakalną nazywa się wodny roztwór amoniaku. Ulatniająca się z niego substancja gazowa ma drażniący zapach oraz powoduje zmianę barwy papierka wskaźnikowego.
Spośród zamieszczonych niżej piktogramów ostrzegawczych wybierz zaznaczając takie dwa, które nie opisują wody amoniakalnej o stężeniu równym 25% masowych. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone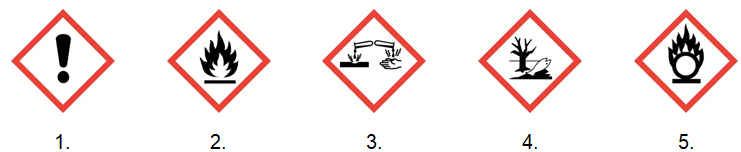
Zadanie 14.1. Zapis równań reakcji chemicznych. Doświadczenia chemiczne w zadaniach część 1. Rozdział 1 (2 punkty)
W celu zbadania charakteru chemicznego wodorotlenku ołowiu(II) przeprowadzono doświadczenie chemiczne według schematu:

W probówce 1. znajdował się wodny roztwór azotanu(V) ołowiu(II). Po dodaniu stałego KOH do probówki 2. zawartością naczynia energicznie wstrząśnięto. Powstały wówczas jony kompleksowe o liczbie koordynacyjnej 4, w których ligandami są aniony wodorotlenkowe.
Widoczny w probówce 4. osad stanowi związek chemiczny, którego iloczyn rozpuszczalności (Ks) w temperaturze 25 oC wynosi około 1,7∙10–5.
Napisz w formie jonowej skróconej równania reakcji chemicznych w wyniku których uzyskano zawartości naczyń widoczne na fotografiach 2. oraz 3. 2.: 3.: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 14.2. Zapis równania reakcji chemicznej oraz określenie charakteru chemicznego. Doświadczenia chemiczne w zadaniach część 1. Rozdział 1 (1 punkt)
W celu zbadania charakteru chemicznego wodorotlenku ołowiu(II) przeprowadzono doświadczenie chemiczne według schematu:

W probówce 1. znajdował się wodny roztwór azotanu(V) ołowiu(II). Po dodaniu stałego KOH do probówki 2. zawartością naczynia energicznie wstrząśnięto. Powstały wówczas jony kompleksowe o liczbie koordynacyjnej 4, w których ligandami są aniony wodorotlenkowe.
Widoczny w probówce 4. osad stanowi związek chemiczny, którego iloczyn rozpuszczalności (Ks) w temperaturze 25 oC wynosi około 1,7∙10–5.
Napisz w formie jonowej równanie reakcji chemicznej podczas której z zawartości probówki 3. powstał osad w probówce 4. Określ charakter chemiczny wodorotlenku ołowiu(II). Równanie reakcji: Charakter chemiczny: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 15.1. Zapis równania reakcji chemicznej. Doświadczenia chemiczne w zadaniach część 1. Rozdział 1 (1 punkt)
W celu zbadania charakteru chemicznego wodorotlenku ołowiu(II) przeprowadzono doświadczenie chemiczne według schematu:

W probówce 1. znajdował się wodny roztwór azotanu(V) ołowiu(II). Po dodaniu stałego KOH do probówki 2. zawartością naczynia energicznie wstrząśnięto. Powstały wówczas jony kompleksowe o liczbie koordynacyjnej 4, w których ligandami są aniony wodorotlenkowe.
Zawartość naczynia widoczną na 4. fotografii można uzyskać również po wprowadzeniu do roztworu w probówce 1. tego samego odczynnika, co do roztworu w probówce 3.
Napisz jonowe równanie chemiczne opisanej przemiany. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 15.2. Wyjaśnienie przyczyny spadku stężenia jonów azotanowych(V). Doświadczenia chemiczne w zadaniach część 1. Rozdział 1 (1 punkt)
W celu zbadania charakteru chemicznego wodorotlenku ołowiu(II) przeprowadzono doświadczenie chemiczne według schematu:

W probówce 1. znajdował się wodny roztwór azotanu(V) ołowiu(II). Po dodaniu stałego KOH do probówki 2. zawartością naczynia energicznie wstrząśnięto. Powstały wówczas jony kompleksowe o liczbie koordynacyjnej 4, w których ligandami są aniony wodorotlenkowe.
Zawartość naczynia widoczną na 4. fotografii można uzyskać również po wprowadzeniu do roztworu w probówce 1. tego samego odczynnika, co do roztworu w probówce 3.
Wyjaśnij, dlaczego stężenie jonów azotanowych(V) maleje w trakcie takiej przemiany, pomimo, że nie biorą one udziału w reakcji chemicznej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 16. Zapis równań reakcji chemicznych. Doświadczenia chemiczne w zadaniach część 1. Rozdział 1 (1 punkt)
W celu odróżnienia rozcieńczonych roztworów – wodorotlenku sodu oraz wodorotlenku baru przeprowadzono doświadczenie chemiczne podczas którego do probówek zawierających badane mieszaniny wprowadzono jeden spośród odczynników:
HCl(aq), KNO3(aq), H2SO4(aq), HI.
Efekt tego doświadczenia przedstawiają fotografie 1. oraz 2.

Uzupełnij poniższe pola odpowiadające numerom probówek równaniami odpowiednich reakcji chemicznych zapisanymi w postaci jonowej skróconej. 1.: 2.: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 17.1. Zapis podpowłokowej konfiguracji elektronowej jonu. Doświadczenia chemiczne w zadaniach część 1. Rozdział 1 (1 punkt)
Jednym ze wskaźników kwasowo-zasadowych jest oranż metylowy, w obecności którego barwa wodnego roztworu zależy od wartości pH. Fotografie o numerach 1 oraz 2, które wykonano w temperaturze 25 oC przedstawiają roztwory uzyskane po wprowadzeniu do wody destylowanej z dodatkiem kilku kropli roztworu oranżu metylowego niektórych spośród odczynników:
BeO(s), P4O10(s), SO3(c), K2O(s), H2SO4(stęż).
Wiadomo, że roztwór 2. ma pH wyższe niż woda destylowana w tej samej temperaturze.

Zamieszczona poniżej fotografia ilustruje pewien związek chemiczny, którego roztwór wodny można uzyskać z wykorzystaniem jednego z wyżej wymienionych tlenków. Zarówno związek ten jak i tlenek wprowadzone do wody z dodatkiem roztworu oranżu metylowego dają efekt widoczny na fotografii 2.

Napisz stosując symbole podpowłok pełną konfigurację elektronową w stanie podstawowym jonu prostego budującego kryształy widocznej na fotografii substancji. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone



