Jednym z mechanizmów regulujących stężenie aktywnego fizjologiczne hormonu roślinnego (fitohormonu) jest koniugacja. Jest to proces kowalencyjnej modyfikacji fitohormonu, która polega na przyłączeniu do cząsteczki hormonu innej substancji chemicznej, np. cukru, alkoholu, aminokwasu lub białka. W efekcie takiej modyfikacji ulegają zmianie właściwości biologiczne i fizykochemiczne hormonu, który wówczas nie może być rozpoznawany przez swoisty receptor.
Koniugacja prowadzi zatem do czasowego wyłączenia aktywności hormonu. W zdecydowanej większości przypadków koniugacja ma charakter odwracalny, kiedy w wyniku hydrolizy enzymatycznej z koniugatu zostaje uwolniony aktywny fitohormon. Regulacja aktywności fitohormonów przez koniugację zachodzi na zasadzie ujemnego sprzężenia zwrotnego.
Auksyny są najwcześniej odkrytymi fitohormonami, które regulują wiele procesów fizjologicznych. W sensie chemicznym są to kwasy aromatyczne, pochodne tryptofanu (np. kwas indolilo-3-octowy – IAA) lub fenyloalaniny (kwas fenylooctowy – PAA). Grupa karboksylowa auksyny jest zaangażowana w tworzenie wiązania estrowego z grupą hydroksylową cukru lub alkoholu podczas tworzenia koniugatów estrowych. Ta reakcja – jak przedstawiono poniżej – ma dwuetapowy przebieg, a każdy z etapów jest katalizowany przez inny enzym.
IAA + UDP-glukoza ↔ IA-glukoza + UDP (1)
IA-glukoza + alkohol → IA-alkohol + glukoza (2)
Reakcja (1) jest katalizowana przez enzym glukozylotransferazę UDPG:IAA, a reakcja (2) – przez acylotransferazę IA-glukoza:alkohol.
W wyniku połączenia grupy karboksylowej auksyny z resztą aminową aminokwasu powstają koniugaty amidowe. Tę dwuetapową reakcję (3, 4) katalizuje jeden enzym syntetaza IA-aminokwasu, która – jak przedstawiono za pomocą równania (3) – wymaga udziału ATP.
IAA + ATP ↔ IA-AMP + PPi (3)
IA-AMP + aminokwas → IA-aminokwas + AMP (4)
Zbadano wpływ kilku stężeń L-tryptofanu (L-Trp) na aktywność enzymu syntezującego koniugat auksyny – IA-asparaginian (IA-Asp). Ze względu na budowę L-tryptofanu – ma pierścień indolowy jak IAA oraz jest aminokwasem jak L-asparaginian – postawiono dwie niewykluczające się hipotezy:
• L-Trp współzawodniczy o miejsce aktywne enzymu z IAA
• L-Trp współzawodniczy o miejsce aktywne enzymu z L-asparaginianem.
Badania prowadzono w dwóch wariantach. W pierwszym wariancie analizowano wpływ pięciu stężeń L-Trp (0,2; 0,6; 1,0; 1,5; 2,5 mM) na aktywność enzymu przy dwóch stężeniach jednego z substratów
– IAA (2 mM; 4 mM). W drugim wariancie badano wpływ wyżej wymienionych stężeń L-Trp na aktywność enzymu przy dwóch stężeniach drugiego z substratów – L-asparaginianu (6 mM; 10 mM). Wyniki przedstawiono na poniższych wykresach.
1. Określ, które stwierdzenia dotyczące koniugacji auksyn są prawdziwe, a które – fałszywe.

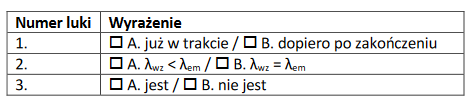
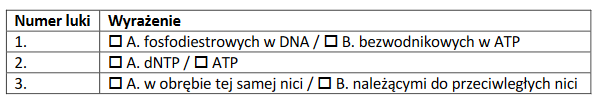
2. Uzupełnij w poniższym tekście luki (1.–3.) wyrażeniami z tabeli, wybierając w każdym przypadku jedno z dwóch zaproponowanych.
Wzrost stężenia auksyny w komórce powoduje (1) transkrypcji genów kodujących enzymy syntetyzujące koniugaty fitohormonu. W efekcie tego dochodzi do (2) stężenia aktywnej auksyny. Koniugaty auksyny są (3) do uruchomienia szlaku transdukcji sygnału hormonalnego.

3. Określ, które stwierdzenia dotyczące wpływu L-tryptofanu na aktywność enzymu syntetazy IA-asparaginianu są prawdziwe, a które – fałszywe.