Zapis równań reakcji biegnących podczas doświadczenia z udziałem kwasu solnego oraz soli kwasu węglowego i fenolu. Zadanie 8.3. Arkusz CKE chemia maj 2018 rozszerzony (2 punkty)
Za pomocą odpowiednio przeprowadzonych doświadczeń można porównać charakter kwasowy fenolu, kwasu solnego i kwasu węglowego.
Napisz w formie jonowej skróconej równania reakcji zachodzących w kolbie i w probówce podczas przeprowadzonego doświadczenia. Równanie reakcji zachodzącej w kolbie: Równanie reakcji zachodzącej w probówce:
Zapis równania autodysocjacji kwasu siarkowego(VI) ze wskazaniem kwasu Brønsteda. Zadanie 9.1. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
Kwas siarkowy(VI) w temperaturze pokojowej jest oleistą cieczą o gęstości prawie dwukrotnie większej niż gęstość wody. Czysty, bezwodny kwas siarkowy(VI) ulega częściowej autodysocjacji, dzięki czemu przewodzi prąd elektryczny. W wyniku reakcji kwasu siarkowego(VI) z wodorotlenkiem sodu, w której stosunek molowy substratów jest równy 1 : 1, powstaje wodorosiarczan(VI) sodu. Wodny roztwór wodorosiarczanu(VI) sodu charakteryzuje się kwasowym odczynem, ponieważ jony obecne w roztworze ulegają reakcji zgodnie z poniższym równaniem:
HSO4– (aq) + H2O ⇄ SO42–(aq) + H3O+ (aq)
Stała równowagi opisanej reakcji w temperaturze T jest równa 1,0·10–2 .
Na podstawie: T. Mizerski, Tablice chemiczne, Warszawa 2004.
Napisz równanie autodysocjacji kwasu siarkowego(VI) polegającej na przeniesieniu protonu z jednej cząsteczki H2SO4 do drugiej. W równaniu podkreśl wzór kwasu Brønsteda sprzężonego z cząsteczką H2SO4 jako zasadą Brønsteda.
Obliczanie pH roztworu wodorosiarczanu(VI) sodu. Zadanie 9.2. Arkusz CKE chemia maj 2018 rozszerzony (2 punkty)
Kwas siarkowy(VI) w temperaturze pokojowej jest oleistą cieczą o gęstości prawie dwukrotnie większej niż gęstość wody. Czysty, bezwodny kwas siarkowy(VI) ulega częściowej autodysocjacji, dzięki czemu przewodzi prąd elektryczny. W wyniku reakcji kwasu siarkowego(VI) z wodorotlenkiem sodu, w której stosunek molowy substratów jest równy 1 : 1, powstaje wodorosiarczan(VI) sodu. Wodny roztwór wodorosiarczanu(VI) sodu charakteryzuje się kwasowym odczynem, ponieważ jony obecne w roztworze ulegają reakcji zgodnie z poniższym równaniem:
HSO4– (aq) + H2O ⇄ SO42–(aq) + H3O+ (aq)
Stała równowagi opisanej reakcji w temperaturze T jest równa 1,0·10–2 .
Na podstawie: T. Mizerski, Tablice chemiczne, Warszawa 2004.
Rozpuszczono 0,600 g NaHSO4 w wodzie i otrzymano 100 cm3 roztworu o temperaturze T. W tym roztworze reakcji z wodą uległo znacznie więcej niż 5% jonów wodorosiarczanowych(VI).
Oblicz pH tego roztworu. Wynik końcowy podaj z dokładnością do trzeciego miejsca po przecinku.
Uszeregowanie roztworów zgodnie ze wzrastającą wartością pH. Zadanie 10. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
W temperaturze T przygotowano wodne roztwory pięciu elektrolitów o jednakowym stężeniu molowym równym 0,1 mol⋅dm−3 . Poniżej podano wzory tych elektrolitów.
KCl HCl NaNO2 NH4Cl KOH
Uszereguj związki o podanych wzorach zgodnie z rosnącym pH ich wodnych roztworów. Napisz wzory tych związków w odpowiedniej kolejności. najniższe pH najwyższe pH
Wybór wskaźnika użytego podczas miareczkowania roztworu kwasu octowego roztworem zasady sodowej. Zadanie 11. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
Do wodnego roztworu kwasu etanowego (octowego) o określonej objętości, ale o nieznanym stężeniu, dodawano kroplami wodny roztwór wodorotlenku sodu o znanym stężeniu i za pomocą pehametru mierzono pH mieszaniny reakcyjnej. W ten sposób przeprowadzono tzw. miareczkowanie pehametryczne, które jest jedną z metod analizy ilościowej. W czasie doświadczenia zachodziła reakcja opisana równaniem:
CH3COOH + NaOH → CH3COONa + H2O
Zestaw użyty w tym doświadczeniu przedstawiono na poniższym schemacie, a otrzymane wyniki miareczkowania umieszczono na wykresie.
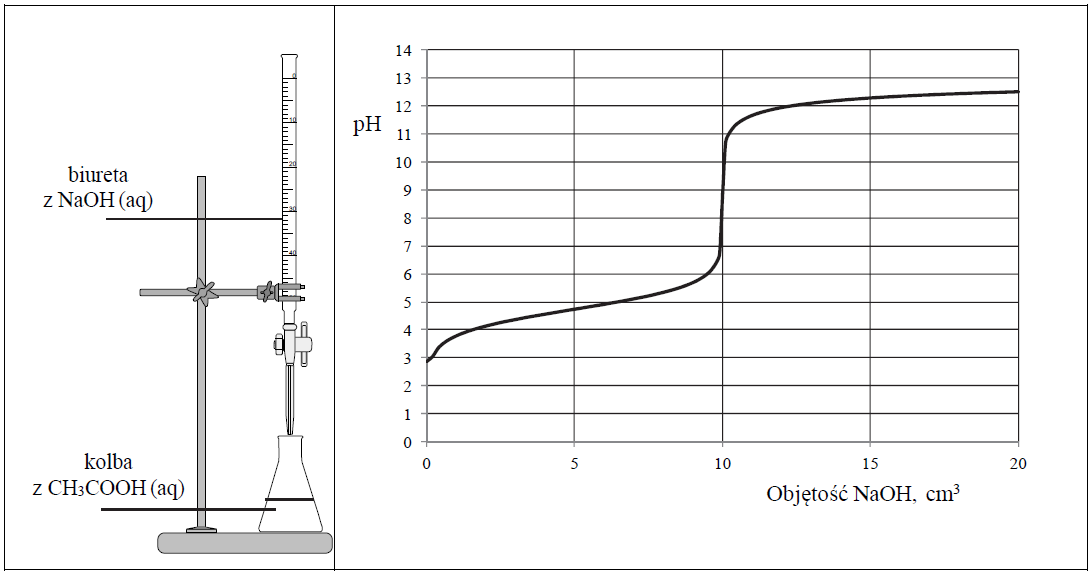
Po dodaniu takiej objętości roztworu wodorotlenku sodu, w jakiej znajdowała się liczba moli NaOH równa liczbie moli CH3COOH w roztworze wziętym do analizy, w układzie został osiągnięty punkt równoważnikowy. Ustalono, że w opisanym doświadczeniu pH w punkcie równoważnikowym było równe 9.
Podczas miareczkowania kwas–zasada zamiast pehametru można stosować wskaźniki pH. Muszą one być tak dobrane, aby zakres zmiany barwy wskaźnika przypadał w pobliżu punktu równoważnikowego miareczkowania.
Właściwości wybranych wskaźników oznaczonych numerami I, II, III i IV przedstawiono w poniższej tabeli.
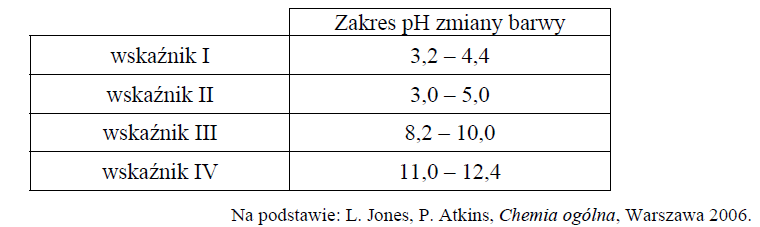
Spośród wskaźników podanych w tabeli i oznaczonych numerami I, II, III i IV wybierz i podaj numer tego wskaźnika, który powinien zostać użyty podczas opisanego miareczkowania roztworu kwasu etanowego.
Określenie odczynu roztworu w punkcie równoważnikowym miareczkowania. Zadanie 12. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
Do wodnego roztworu kwasu etanowego (octowego) o określonej objętości, ale o nieznanym stężeniu, dodawano kroplami wodny roztwór wodorotlenku sodu o znanym stężeniu i za pomocą pehametru mierzono pH mieszaniny reakcyjnej. W ten sposób przeprowadzono tzw. miareczkowanie pehametryczne, które jest jedną z metod analizy ilościowej. W czasie doświadczenia zachodziła reakcja opisana równaniem:
CH3COOH + NaOH → CH3COONa + H2O
Zestaw użyty w tym doświadczeniu przedstawiono na poniższym schemacie, a otrzymane wyniki miareczkowania umieszczono na wykresie.

Po dodaniu takiej objętości roztworu wodorotlenku sodu, w jakiej znajdowała się liczba moli NaOH równa liczbie moli CH3COOH w roztworze wziętym do analizy, w układzie został osiągnięty punkt równoważnikowy. Ustalono, że w opisanym doświadczeniu pH w punkcie równoważnikowym było równe 9.
Uzupełnij poniższe zdanie – wybierz i podkreśl jedno określenie spośród podanych w nawiasie. Odpowiedź uzasadnij, odwołując się do procesu zachodzącego w roztworze. W opisanym doświadczeniu odczyn roztworu w punkcie równoważnikowym jest (kwasowy / obojętny / zasadowy). Uzasadnienie:
Wskazanie wzoru jonu, którego stężenie jest największe po zakończeniu miareczkowania. Zadanie 13. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
Do wodnego roztworu kwasu etanowego (octowego) o określonej objętości, ale o nieznanym stężeniu, dodawano kroplami wodny roztwór wodorotlenku sodu o znanym stężeniu i za pomocą pehametru mierzono pH mieszaniny reakcyjnej. W ten sposób przeprowadzono tzw. miareczkowanie pehametryczne, które jest jedną z metod analizy ilościowej. W czasie doświadczenia zachodziła reakcja opisana równaniem:
CH3COOH + NaOH → CH3COONa + H2O
Zestaw użyty w tym doświadczeniu przedstawiono na poniższym schemacie, a otrzymane wyniki miareczkowania umieszczono na wykresie.

Po dodaniu takiej objętości roztworu wodorotlenku sodu, w jakiej znajdowała się liczba moli NaOH równa liczbie moli CH3COOH w roztworze wziętym do analizy, w układzie został osiągnięty punkt równoważnikowy. Ustalono, że w opisanym doświadczeniu pH w punkcie równoważnikowym było równe 9.
Podaj wzór jonu, którego stężenie jest największe w roztworze otrzymanym po dodaniu 18 cm3 wodnego roztworu wodorotlenku sodu do analizowanego roztworu kwasu etanowego.
Obliczanie wartości stałej równowagi reakcji chemicznej. Zadanie 14. Arkusz CKE chemia maj 2018 rozszerzony (2 punkty)
Dwa gazy A i B zmieszane w stosunku molowym nA : nB = 1 : 4 zajmują w warunkach normalnych objętość 1 dm3. Tę mieszaninę umieszczono w reaktorze o stałej pojemności 1 dm3 i w temperaturze T zainicjowano reakcję. W tej temperaturze ustalił się stan równowagi opisany równaniem:
A (g) + 2B (g) ⇄ 2C (g) ΔH < 0
W stanie równowagi stężenie substancji C było równe 0,004 mol · dm–3.
Oblicz stężeniową stałą równowagi (Kc) opisanej reakcji w temperaturze T.
Ocena poprawności zdań dotyczących reakcji równowagowej. Zadanie 15. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
Dwa gazy A i B zmieszane w stosunku molowym nA : nB = 1 : 4 zajmują w warunkach normalnych objętość 1 dm3. Tę mieszaninę umieszczono w reaktorze o stałej pojemności 1 dm3 i w temperaturze T zainicjowano reakcję. W tej temperaturze ustalił się stan równowagi opisany równaniem:
A (g) + 2B (g) ⇄ 2C (g) ΔH < 0
W stanie równowagi stężenie substancji C było równe 0,004 mol · dm–3.
Oceń, czy poniższe informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa. 1. W stałej temperaturze T ciśnienie w reaktorze w stanie równowagi było niższe niż w chwili początkowej. 2. W warunkach izotermicznych (T = const) wzrost ciśnienia wywołany sprężeniem mieszaniny gazów w stanie równowagi poskutkuje spadkiem wydajności otrzymywania substancji C. 3. W warunkach izobarycznych (p = const) wzrost temperatury mieszaniny gazów w stanie równowagi poskutkuje spadkiem wydajności otrzymywania substancji C.
Zapis równań reakcji z użyciem buforu fosforanowego w środowisku kwasowym i zasadowym. Zadanie 17. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
Wartości pH wody oraz wodnych roztworów kwasów i wodorotlenków mogą ulegać znacznym zmianom podczas dodawania do nich mocnych kwasów lub zasad. Istnieją jednak roztwory, których pH zmienia się nieznacznie po dodaniu mocnego kwasu lub zasady na skutek reakcji składników roztworu z jonami wodorowymi lub jonami wodorotlenkowymi. Nazywamy je buforami pH. Buforowe właściwości mają roztwory zawierające sprzężoną parę kwas–zasada Brønsteda w podobnych stężeniach, np.: słaby kwas i jego sól z mocną zasadą, słabą zasadę i jej sól z mocnym kwasem, słaby kwas wieloprotonowy i jego wodorosól lub mieszaninę wodorosoli.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004.
Jednym z buforów odpowiedzialnych za utrzymanie równowagi kwasowo-zasadowej krwi jest bufor fosforanowy, który można otrzymać przez rozpuszczenie dwóch wodorosoli kwasu ortofosforowego(V) w wodzie.
Napisz w formie jonowej skróconej dwa równania reakcji ilustrujące działanie opisanego buforu fosforanowego. Przyjmij, że substraty reagują w stosunku molowym 1 : 1.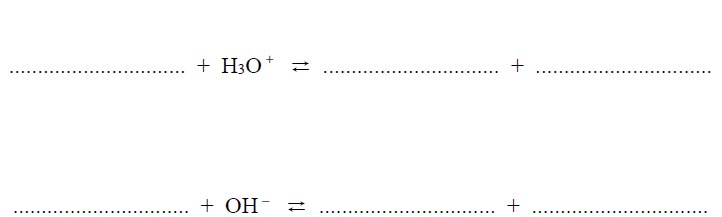
Uszeregowanie metali według według malejącej aktywności chemicznej. Zadanie 18.1. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
Przeprowadzono doświadczenie, którego celem było porównanie aktywności chemicznej czterech metali: talu (Tl), technetu (Tc), hafnu (Hf) i molibdenu (Mo). Stwierdzono, że z udziałem wymienionych metali i ich jonów samorzutnie zachodzą reakcje, których przebieg ilustrują poniższe równania w formie jonowej skróconej:
I 3Hf + 4Mo3+ → 3Hf4+ + 4Mo
II 3Tl +Mo3+ → 3Tl+ +Mo
III Hf + Tc4+ → Hf4+ + Tc
IV Hf + 4Tl+ → Hf4+ + 4Tl
V 4Mo + 3Tc4+ → 4Mo3+ + 3Tc
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 1997.
Uszereguj wymienione metale według malejącej aktywności chemicznej – napisz ich symbole w odpowiedniej kolejności.
Wybór jonu stanowiącego najsilniejszy utleniacz i najsilniejszy reduktor. Zadanie 18.2. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
Przeprowadzono doświadczenie, którego celem było porównanie aktywności chemicznej czterech metali: talu (Tl), technetu (Tc), hafnu (Hf) i molibdenu (Mo). Stwierdzono, że z udziałem wymienionych metali i ich jonów samorzutnie zachodzą reakcje, których przebieg ilustrują poniższe równania w formie jonowej skróconej:
I 3Hf + 4Mo3+ → 3Hf4+ + 4Mo
II 3Tl +Mo3+ → 3Tl+ +Mo
III Hf + Tc4+ → Hf4+ + Tc
IV Hf + 4Tl+ → Hf4+ + 4Tl
V 4Mo + 3Tc4+ → 4Mo3+ + 3Tc
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 1997.
Spośród kationów biorących udział w opisanych reakcjach wybierz jon, który jest najsilniejszym utleniaczem, i jon, który jest najsłabszym utleniaczem. Napisz wzory wybranych jonów. Najsilniejszy utleniacz: Najsłabszy utleniacz:
Obliczanie stężenia procentowego soli bezwodnej na podstawie rozpuszczalności jej hydratu. Zadanie 19. Arkusz CKE chemia maj 2018 rozszerzony (2 punkty)
W temperaturze 20 oC rozpuszczalność uwodnionego wodorosiarczanu(VI) sodu o wzorze NaHSO4 · H2O jest równa 67 gramów w 100 gramach wody.
Na podstawie: T. Mizerski, Tablice chemiczne, Warszawa 2004.
Oblicz, jaki procent masy roztworu nasyconego o temperaturze 20 oC stanowi masa soli bezwodnej NaHSO4.
Zapis równania reakcji otrzymywania wodorotlenku niklu(II). Zadanie 20. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
Wodorotlenek niklu(II) strąca się jako zielonkawy osad z wodnego roztworu soli niklu(II) pod działaniem wodnego roztworu wodorotlenku sodu. Wodorotlenek niklu(II) nie rozpuszcza się w nadmiarze zasady, ale reaguje z kwasami. Pod wpływem utleniaczy ten wodorotlenek przechodzi w czarnobrunatny wodorotlenek niklu(III).
Na podstawie: J. Minczewski, Z. Marczenko, Chemia analityczna. Podstawy teoretyczne i analiza jakościowa, Warszawa 2001.
Do probówki z wodnym roztworem chlorku niklu(II) dodano nadmiar wodnego roztworu wodorotlenku sodu.
Napisz w formie jonowej skróconej równanie reakcji otrzymywania wodorotlenku niklu(II) w sposób opisany powyżej. Określ charakter chemiczny (kwasowy, zasadowy, obojętny, amfoteryczny) wodorotlenku niklu(II). Równanie reakcji: Charakter chemiczny wodorotlenku niklu(II):

