Wybór wskaźnika użytego podczas miareczkowania roztworu kwasu octowego roztworem zasady sodowej. Zadanie 11. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
Do wodnego roztworu kwasu etanowego (octowego) o określonej objętości, ale o nieznanym stężeniu, dodawano kroplami wodny roztwór wodorotlenku sodu o znanym stężeniu i za pomocą pehametru mierzono pH mieszaniny reakcyjnej. W ten sposób przeprowadzono tzw. miareczkowanie pehametryczne, które jest jedną z metod analizy ilościowej. W czasie doświadczenia zachodziła reakcja opisana równaniem:
CH3COOH + NaOH → CH3COONa + H2O
Zestaw użyty w tym doświadczeniu przedstawiono na poniższym schemacie, a otrzymane wyniki miareczkowania umieszczono na wykresie.
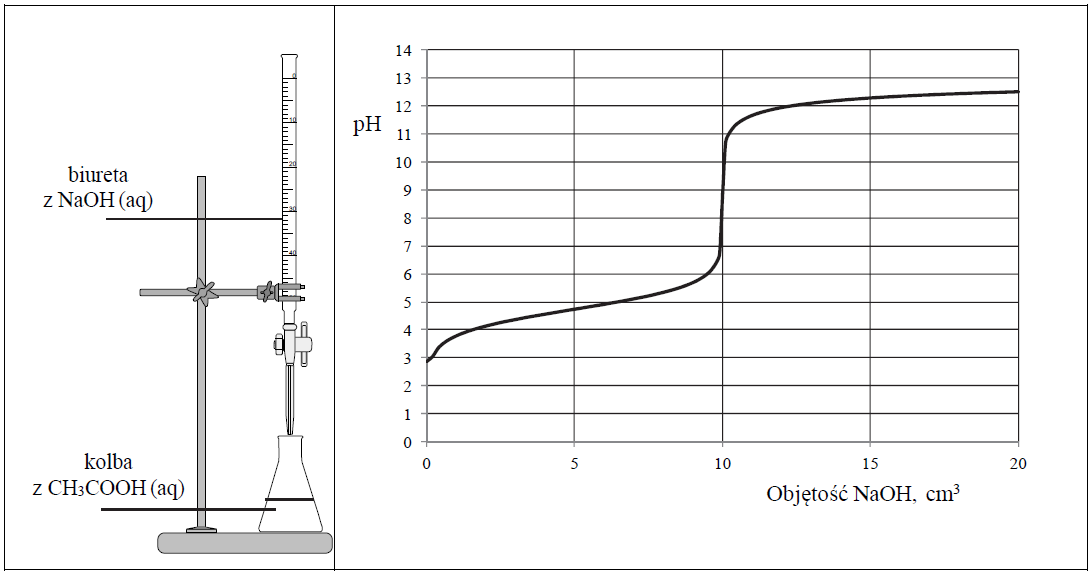
Po dodaniu takiej objętości roztworu wodorotlenku sodu, w jakiej znajdowała się liczba moli NaOH równa liczbie moli CH3COOH w roztworze wziętym do analizy, w układzie został osiągnięty punkt równoważnikowy. Ustalono, że w opisanym doświadczeniu pH w punkcie równoważnikowym było równe 9.
Podczas miareczkowania kwas–zasada zamiast pehametru można stosować wskaźniki pH. Muszą one być tak dobrane, aby zakres zmiany barwy wskaźnika przypadał w pobliżu punktu równoważnikowego miareczkowania.
Właściwości wybranych wskaźników oznaczonych numerami I, II, III i IV przedstawiono w poniższej tabeli.
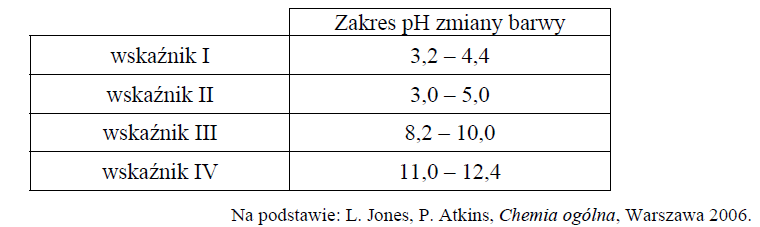
Spośród wskaźników podanych w tabeli i oznaczonych numerami I, II, III i IV wybierz i podaj numer tego wskaźnika, który powinien zostać użyty podczas opisanego miareczkowania roztworu kwasu etanowego.