Obliczanie wartości pH roztworu kwasu chlorowego(III) na podstawie liczby jonów chloranowych(III)
W temperaturze 298 K pewien wodny roztwór kwasu chlorowego(III) o objętości 200 cm3 jest układem homogenicznym, w którym znajduje się 1,204·1021 anionów chloranowych(III).
Oblicz wartość pH opisanej mieszaniny. Wynik podaj z dokładnością do cyfry jedności. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określenie, których drobin jest więcej w roztworze kwasu chlorowego(III) o określonej liczbie jonów chloranowych(III)
W temperaturze 298 K pewien wodny roztwór kwasu chlorowego(III) o objętości 200 cm3 jest układem homogenicznym, w którym znajduje się 1,204·1021 anionów chloranowych(III).
Ustal na podstawie niezbędnych obliczeń, jakich drobin jest więcej w opisanym roztworze – cząsteczek kwasu, czy anionów chloranowych(III)? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie zakresu pH odpowiedniego dla prawidłowego funkcjonowania organizmu
W celu zapewnienia właściwych warunków funkcjonowania organizmu ludzkiego, wartości stężeń jonów wodorowych we wszystkich jego przestrzeniach wodnych powinny mieścić się w zakresie 35÷45 nmol/l. Stężenie wyższe, niż podana wartość graniczna występuje w przypadku tzw. kwasicy, natomiast niższe, gdy mamy do czynienia z zasadowicą.
Na podstawie: W. Noszczyk, Chirurgia, Warszawa 2016.
Oblicz, jakiemu zakresowi pH odpowiada stężenie jonów wodorowych zapewniające właściwe warunki jego funkcjonowania? Wynik podaj z dokładnością do trzech cyfr znaczących, zaczynając od najniższej obliczonej wartości pH. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zależność pH roztworu aminy od stężenia roztworu
W pewnej temperaturze T stała równowagi procesu dysocjacji elektrolitycznej etanoaminy ma wartość 5∙10–4.
Oblicz, jak zmieni się stężenie molowe roztworu tej aminy, jeśli w wyniku rozcieńczenia wodą destylowaną w temperaturze T, pH tego roztworu obniży się od wartości równej 11 do 9. Wynik podaj z dokładnością do cyfry jedności. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie wartości pH octu stołowego
Ocet stołowy jest 10-procentowym, wodnym roztworem kwasu etanowego, którego gęstość w temperaturze 25 ⁰C wynosi 1,02 g/cm3.
Oblicz wartość pH opisanego roztworu. Wynik podaj z dokładnością do trzech cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie wartości pH 1-procentowego roztworu kwasu solnego
Wodny roztwór kwasu solnego o stężeniu równym 1% nie jest klasyfikowany jako substancja niebezpieczna.
Oblicz wartość pH opisanego roztworu przyjmując, że jego gęstość równa jest gęstości wody destylowanej. Wynik podaj z dokładnością do dwóch cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
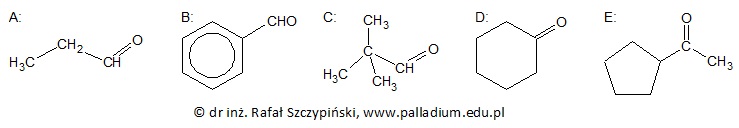
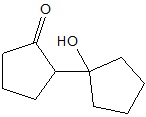
Określanie typu hybrydyzacji orbitali walencyjnych określonego atomu węgla oraz liczby wiązań sigma jakie tworzy
Aldehydy oraz ketony, których cząsteczki zawierają atom wodoru połączony z atomem węgla α (atomem węgla bezpośrednio połączonym z grupą karbonylową), w silnie alkalicznym środowisku ulegają reakcji kondensacji aldolowej. W przypadku aldehydów reakcja ta przebiega według ogólnego schematu:
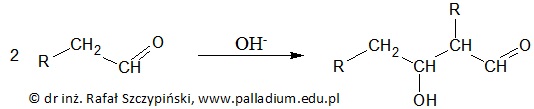
Opisany proces inicjowany jest przez oderwanie jednego z atomów wodoru, przyłączonego do atomu węgla α, co w konsekwencji prowadzi do utworzenia karboanionu. Rysunek poniżej przedstawia ogólny schemat budowy karboanionu powstałego w wyniku oderwania protonu od atomu węgla α cząsteczki aldehydu:
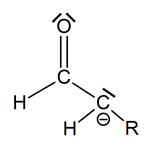
Na podstawie: J. McMurry, Chemia organiczna, Warszawa 2012.
Określ liczbę wiązań σ jakie tworzy atom węgla na którym zlokalizowany jest ładunek ujemny oraz typ hybrydyzacji (sp, sp2, sp3) jego orbitali walencyjnych. Liczba wiązań σ: Typ hybrydyzacji: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie wartości pH roztworu kwasu mrówkowego zawierającego określoną masę kwasu
W zlewce przygotowano 400 cm3 wodnego roztworu kwasu mrówkowego poprzez zmieszanie 9,2 g tego związku chemicznego z odpowiednią ilością wody destylowanej.
Oblicz wartość pH uzyskanego w ten sposób roztworu kwasu mrówkowego. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie, ile razy zmniejszyła się zawartość kwasu mrówkowego w wyniku ogrzewania jego wodnego roztworu
W zlewce przygotowano 400 cm3 wodnego roztworu kwasu mrówkowego poprzez zmieszanie 9,2 g tego związku chemicznego z odpowiednią ilością wody destylowanej.
Opisany roztwór ogrzewano w pewnych warunkach i stwierdzono, że jego objętość zmniejszyła się o 50 cm3. Po zakończeniu ogrzewania i ochłodzeniu zawartości naczynia pozostały w nim roztwór miał pH równe 2,3. Określ, wykonując niezbędne obliczenia, ile razy zmniejszyła się zawartość kwasu mrówkowego w znajdującym się w zlewce roztworze, w wyniku ogrzewania jej zawartości? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie entalpii tworzenia tlenku siarki(VI) na podstawie prawa Hessa
W tabeli poniżej zebrano dane na temat trzech niezależnych od siebie procesów chemicznych, podczas których biegną po dwie reakcje chemiczne.

Na podstawie: I. P. Muchlenow i inni, Ogólna technologia chemiczna, Warszawa 1974.
Na podstawie danych zebranych w odpowiednim wierszu tabeli oblicz efekt cieplny (entalpię) towarzyszący utworzeniu jednego mola tlenku siarki(VI) z pierwiastków w postaci termodynamicznie trwałej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone