Bilansowanie równania reakcji chemicznej z udziałem aldehydu oraz określenie jego wzoru półstrukturalnego (próba Tollensa)
W cząsteczkach pewnego nasyconego, nierozgałęzionego aldehydu znajdują się dwie grupy karbonylowe. W celu ustalenia wzoru strukturalnego tego związku chemicznego, na jego próbkę o masie równej 2,15 g podziałano odczynnikiem Tollensa. Na ściankach naczynia osadziło się 10,8 g metalicznego srebra.
Napisz w formie jonowej skróconej równanie opisanej reakcji chemicznej. W tym celu wykorzystaj ogólny wzór szeregu homologicznego do którego należy poddany reakcji aldehyd. Współczynniki uzgodnij metodą bilansu jonowo-elektronowego. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie wzoru grupowego oraz nazwy aldehydu na podstawie przeprowadzonej reakcji chemicznej
W cząsteczkach pewnego nasyconego, nierozgałęzionego aldehydu znajdują się dwie grupy karbonylowe. W celu ustalenia wzoru strukturalnego tego związku chemicznego, na jego próbkę o masie równej 2,15 g podziałano odczynnikiem Tollensa. Na ściankach naczynia osadziło się 10,8 g metalicznego srebra.
Na podstawie stosownych obliczeń ustal wzór półstrukturalny (grupowy) cząsteczki opisanego aldehydu i podaj jego nazwę systematyczną. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Opis obserwacji na podstawie obliczeń dotyczących zmiany pH roztworu wodorotlenku baru
W tabeli zamieszczono dane na temat wybranych wskaźników kwasowo-zasadowych:
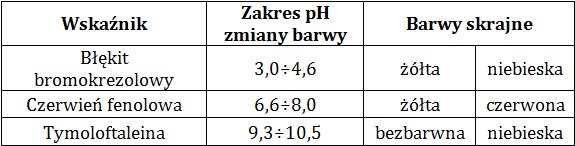
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
W trzech probówkach umieszczono kolejno po 5 cm3 wodnych roztworów związków chemicznych o stężeniach:
Ba(OH)2 2·10–4 mol·dm–3, HClO2 2·10–2 mol·dm–3 oraz HClO 2·10–4 mol·dm–3.
Do probówki z podanym roztworem wodorotlenku baru dodano tymoloftaleinę. Po wstrząśnięciu zawartość naczynia przelano do zlewki i dodano 595 cm3 wody destylowanej.
Napisz, co zaobserwowano w wyniku rozcieńczenia roztworu? Swoją odpowiedź uzasadnij odpowiednimi obliczeniami. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Rysowanie wzoru półstrukturalnego węglowodoru ulegającego ozonolizie oraz zapis jego nazwy
W celu ustalenia struktury cząsteczek alkenów poddaje się je procesowi ozonolizy, której schemat zilustrowano poniższym rysunkiem.

Na rysunku tym R1÷R4 oznaczają ugrupowania węglowodorowe lub atomy wodoru.
Na podstawie: J. McMurry, Chemia organiczna, Warszawa 2012.
Podaj nazwę systematyczną węglowodoru oraz narysuj wzór półstrukturalny jego cząsteczki, z której w wyniku procesu ozonolizy powstają cząsteczki acetonu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie nazw systematycznych produktów ozonolizy cyklicznego dienu
W celu ustalenia struktury cząsteczek alkenów poddaje się je procesowi ozonolizy, której schemat zilustrowano poniższym rysunkiem.

Na rysunku tym R1÷R4 oznaczają ugrupowania węglowodorowe lub atomy wodoru.
Na podstawie: J. McMurry, Chemia organiczna, Warszawa 2012.
Podaj nazwy systematyczne organicznych produktów ozonolizy węglowodoru o nazwie 1,5-dimetylocykloheksa-1,4-dien. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Rysowanie projekcji Fischera enancjomeru cząsteczki kwasu D-glukonowego (izomeria optyczna)
Schemat biochemicznego procesu, w wyniku którego β-D-glukopiranoza przekształcona zostaje w kwas D-glukonowy ilustruje rysunek poniżej:
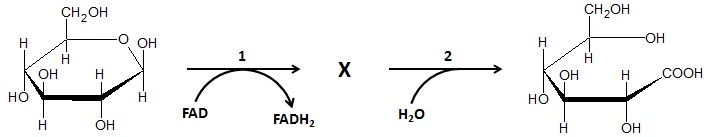
Na podstawie: J. Kączkowski, Podstawy biochemii, Warszawa 1976.
Narysuj wzór cząsteczki będącej enancjomerem kwasu D-glukonowego. W tym celu uzupełnij poniższy szablon projekcji Fischera. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone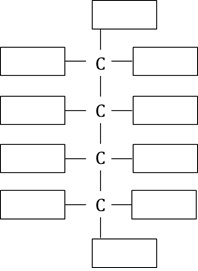
Odróżnianie wodnych roztworów D-glukozy oraz kwasu D-glukonowego
Schemat biochemicznego procesu, w wyniku którego β-D-glukopiranoza przekształcona zostaje w kwas D-glukonowy ilustruje rysunek poniżej:

Na podstawie: J. Kączkowski, Podstawy biochemii, Warszawa 1976.
Zgromadzono zestaw kilku odczynników chemicznych: płyn Lugola, NaOH(aq), KHCO3(aq), fenoloftaleina, NH3(aq).
Z podanego zestawu wybierz jeden taki odczynnik, którego użycie pozwoli odróżnić wodny roztwór β-D-glukopiranozy od wodnego roztworu kwasu D-glukonowego. Zapisz stosowne obserwacje – uzupełnij tabelę. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone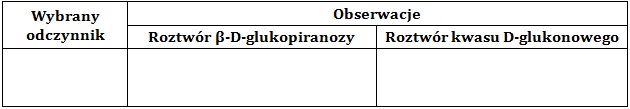
Obliczanie sumarycznego stężenia jonów w roztworze o określonej wartości pH
W temperaturze 25 ⁰C stała równowagi reakcji dysocjacji kwasu chlorowego(III) ma wartość 1,1∙10–².
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Oblicz, jakie powinno być sumaryczne stężenie molowe jonów H+ oraz Cl– w roztworze kwasu solnego, aby wartość pH tego roztworu była identyczna, jak roztworu kwasu chlorowego(III) o stężeniu 0,1 mol∙dm–³? Wynik obliczeń podaj z dokładnością do trzeciego miejsca po przecinku. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Charakterystyka zawartości probówek podczas kilku etapów doświadczenia z udziałem fenolu oraz acetonu
W dwóch różnych probówkach umieszczono wodne roztwory właściwe fenolu i acetonu. Następnie do każdego z naczyń dodano kolejno płyn Lugola (wodny roztwór zawierający jod i jodek potasu) oraz roztwór wodorotlenku sodu.

Uzupełnij pola tabeli wyrazami charakteryzującymi zawartość każdej z probówek w danym momencie doświadczenia: bezbarwny, szafirowy, brunatny, niebieski, żółty osad, ceglasty osad. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Rysowanie wzorów grupowych produktów ciągu przemian z udziałem metanolu oraz związku Grignarda
Związki karbonylowe mogą być stosowane w reakcjach otrzymywania alkoholi, przy czym proces taki prowadzi się z udziałem tzw. związku Grignarda, którego przykładem może być bromek etylomagnezowy (CH3CH2MgBr). Ogólny schemat opisanej przemiany ilustruje rysunek:
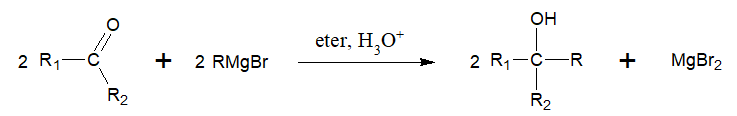
Na zamieszczonym schemacie R, R1 oraz R2 są resztami węglowodorowymi lub atomami wodoru.
Na podstawie: J. McMurry, Chemia organiczna, Warszawa 2012.
W pewnych warunkach przeprowadzono utlenianie metanolu. Uzyskany produkt X poddano reakcji z chlorkiem metylomagnezowym i uzyskano najbliższy homolog Y wyjściowego substratu opisanego ciągu przemian.
Narysuj wzory grupowe związków chemicznych X oraz Y. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie barwy wskaźnika kwasowo-zasadowego na podstawie wartości pH roztworu uzyskanego po zmieszaniu roztworów kwasu i zasady
Roztwory wodne o wartości pH poniżej 3,2, zawierające oranż metylowy mają barwę czerwoną, a o wartości pH powyżej 4,4 – żółtą.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Określ, jaką barwę przyjmie oranż metylowy w roztworze uzyskanym w wyniku zmieszania 10 cm³ roztworu wodorotlenku potasu (0,001 mol∙dm–³) z 10 cm³ roztworu kwasu solnego (0,05 mol∙dm–³)? Odpowiedź uzasadnij obliczeniami. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie wartości pH roztworu kwasu bromowodorowego na podstawie liczby jonów bromkowych
W 300 cm3 pewnego roztworu kwasu bromowodorowego znajduje się 2,71·1020 anionów bromkowych.
Ustal na podstawie niezbędnych obliczeń wartość pH tego roztworu. Wynik podaj z dokładnością do pierwszego miejsca po przecinku. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone


