Rysowanie półstrukturalnego wzoru mniej trwałego spośród izomerów geometrycznych oraz wyjaśnienie przyczyny istnienia izomerów geometrycznych (izomeria geometryczna)
Trwałość izomerów geometrycznych zależy od tzw. oddziaływania przestrzennego (sterycznego) między dwoma objętościowymi podstawnikami po tej samej stronie wiązania podwójnego. Im oddziaływanie to jest silniejsze (podstawniki zajmują więcej miejsca w przestrzeni), tym izomer wykazuje mniejszą trwałość.
Na podstawie: J. McMurry, Chemia organiczna, Warszawa 2012.
Przykładem węglowodoru, który występuje w postaci izomerów geometrycznych jest związek chemiczny o nazwie 3-metylopent-2-en.
Narysuj wzór półstrukturalny (grupowy) mniej trwałego wśród izomerów geometrycznych węglowodoru, którego nazwę systematyczną podano w informacji wprowadzającej, a następnie wyjaśnij, dlaczego 3-metylopent-2-en może występować w postaci izomerów geometrycznych cis-trans? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wskazanie czynnego optycznie produktu reakcji chemicznej oraz uzasadnienie, czy jest to produkt główny, czy uboczny (izomeria optyczna)
Trwałość izomerów geometrycznych zależy od tzw. oddziaływania przestrzennego (sterycznego) między dwoma objętościowymi podstawnikami po tej samej stronie wiązania podwójnego. Im oddziaływanie to jest silniejsze (podstawniki zajmują więcej miejsca w przestrzeni), tym izomer wykazuje mniejszą trwałość.
Na podstawie: J. McMurry, Chemia organiczna, Warszawa 2012.
Przykładem węglowodoru, który występuje w postaci izomerów geometrycznych jest związek chemiczny o nazwie 3-metylopent-2-en.
Jeden z izomerów opisanego węglowodoru o takim samym szkielecie węglowym poddano działaniu bromowodoru. Uzyskano mieszaninę czynnych optycznie związków chemicznych.
Podaj nazwę systematyczną tego produktu, który występuje w postaci diastereoizomerów. Określ, czy jest to główny, czy uboczny produkt przebiegającej reakcji chemicznej. Uzasadnij swoje stanowisko. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wskazanie probówek, w których masa blaszki uległa zwiększeniu po wprowadzeniu do roztworu soli niklu (blaszki)
Do czterech probówek zawierających kolejno blaszki: kadmową, miedzianą, cynkową oraz srebrną dodano wodnego roztworu NiSO4, który ma barwę zieloną.
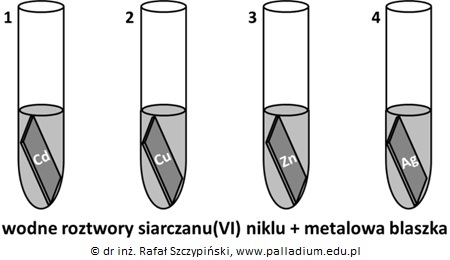
Po zakończeniu doświadczenia stwierdzono, że masy niektórych blaszek uległy zmianie.
Podaj numery tych probówek, w których masa blaszek uległa zwiększeniu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wskazanie probówek, w których nie zaobserwowano objawów reakcji po wprowadzeniu blaszki do roztworu soli niklu (blaszki)
Do czterech probówek zawierających kolejno blaszki: kadmową, miedzianą, cynkową oraz srebrną dodano wodnego roztworu NiSO4, który ma barwę zieloną.

Wymień numery tych probówek, w których nie zaobserwowano objawów świadczących o przebiegu reakcji chemicznej oraz napisz, co zaobserwowano w probówkach, w których reakcja przebiegła? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Opis obserwacji towarzyszących przeprowadzonemu doświadczeniu z udziałem związków chromu
W probówce umieszczono zalkalizowany, wodny roztwór tetrahydroksochromianu(III) sodu. Do naczynia tego dodano następnie roztwór zawierający stechiometryczną ilość chloranu(III) sodu i zaobserwowano zmiany świadczące o przebiegu reakcji chemicznej, a w układzie pojawiły się jony chlorkowe.
Uzyskana mieszanina poreakcyjna została silnie zakwaszona i lekko ogrzana.
Napisz, jaką barwę przyjął roztwór w wyniku przeprowadzenia opisanych czynności? Barwa bezpośrednio po dodaniu kwasu: Barwa po ogrzaniu zawartości naczynia: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równania procesu utleniania aldehydu cynamonowego do kwasu cynamonowego
Charakterystyczny zapach olejku cynamonowego zawdzięcza się występowaniu w nim oleistej cieczy zwanej aldehydem cynamonowym. Wzór półstrukturalny cząsteczki tego związku chemicznego można przedstawić w postaci:
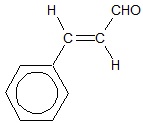
Aldehyd cynamonowy w środowisku kwasowym, w sposób katalityczny można przekształcić w kwas cynamonowy. Napisz, stosując bilans jonowo-elektronowy oraz grupowe wzory związków organicznych równanie połówkowe opisanego procesu utleniania. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Bilansowanie równania reakcji redoks z udziałem siarkowodoru oraz zakwaszonego roztworu dwuchromianu(VI) potasu
Przeprowadzono doświadczenie, którego schemat ilustruje rysunek poniżej. Podczas przebiegu tego eksperymentu zastosowano nadmiar kwasu siarkowego(VI) oraz zaobserwowano między innymi wytrącenie się żółtego osadu, który w wyniku spalenia w tlenie daje gazowy produkt o drażniącej woni. Związek ten powoduje odbarwienie zakwaszonego roztworu manganianu(VII) potasu. Zastosowane ilości siarkowodoru oraz dwuchromianu(VI) potasu były względem siebie w stosunku stechiometrycznym, a reakcja w płuczce przebiegła ze 100% wydajnością. Zebrany w cylindrze gaz X zajął objętość równą 647 cm3 (w przeliczeniu na warunki normalne).
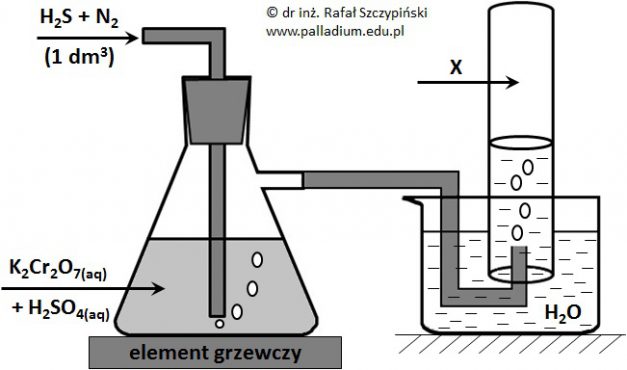
Napisz w formie jonowej skróconej równanie reakcji jaka przebiegła w płuczce. Współczynniki stechiometryczne uzgodnij metodą bilansu jonowo-elektronowego. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone

