Ustalanie ciśnień cząstkowych tlenku węgla(IV) oraz tlenu w ich gazowej mieszaninie o określonej objętości
Ułamkiem molowym składnika mieszaniny nazywa się stosunek liczby moli tego składnika do sumarycznej liczby moli wszystkich składników mieszaniny. W przypadku związków jonowych, poszczególne drobiny z jakich są one zbudowane traktuje się wówczas jak niezależne składniki mieszaniny. W mieszaninach substancji gazowych, udziały poszczególnych składników często wyraża się za pomocą ich ciśnień cząstkowych (pi), co można przedstawić wyrażeniem:
pi = xi · p
Wielkość p jest ciśnieniem całkowitym mieszaniny gazów, natomiast xi jest ułamkiem molowym danego jej składnika.
Pewna mieszanina w temperaturze 100 oC zajmuje objętość równą 37,2 dm3 i składa się z 15,4 g tlenku węgla(IV) oraz 27,2 g tlenu.
Ustal wartości ciśnień cząstkowych poszczególnych jej składników. Wyniki podaj w hektopaskalach (hPa) z dokładnością do pierwszego miejsca po przecinku. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Procentowa wydajność reakcji syntezy tlenku siarki(VI) obliczona na podstawie składu ilościowego mieszaniny reagentów
Ułamkiem molowym składnika mieszaniny nazywa się stosunek liczby moli tego składnika do sumarycznej liczby moli wszystkich składników mieszaniny. W wyniku prowadzonej w obecności katalizatora reakcji tlenu z tlenkiem siarki(IV) powstaje tlenek siarki(VI). Przygotowano 51,2 g mieszaniny substratów, w której procent wagowy tego o mniejszej masie cząsteczkowej wynosił 25%.
Oblicz procentową wydajność opisanej przemiany, jeśli ułamek molowy produktu w poreakcyjnej mieszaninie reagentów równy był 0,2. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie zmiany masy blaszki do momentu 5-krotnego zmniejszenia się stężenia jonów srebra
W kolbie umieszczono 200 cm3 roztworu azotanu(V) srebra zawierającego 1,7 g substancji rozpuszczonej. W roztworze tym zanurzono blaszkę wykonaną z ołowiu.
Na podstawie niezbędnych obliczeń ustal, o ile miligramów zmieniła się masa blaszki do momentu, w którym stężenie jonów Ag+ zmalało 5-krotnie? Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie nazw alkoholi reagujących z wapniem według określonej stechiometrii
Pewne nasycone, izomeryczne alkohole łańcuchowe reagują z wapniem w stosunku wagowym równym (odpowiednio) 3:1, natomiast z sodem w stosunku molowym 1:1.
Wykonaj stosowne obliczenia, a następnie podaj nazwy systematyczne wszystkich alkoholi spełniających podane w informacji wprowadzającej warunki. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie barwy roztworu na podstawie przeprowadzonego eksperymentu z udziałem chromu
W kolbie wypełnionej argonem umieszczono blaszkę wykonaną z chromu. Do naczynia wprowadzono następnie nadmiar odpowietrzonego, 10% roztworu kwasu siarkowego(VI). Po zakończeniu przebiegu reakcji chemicznej uzyskany roztwór rozlano do dwóch zlewek i zmontowano układ zilustrowany rysunkiem:
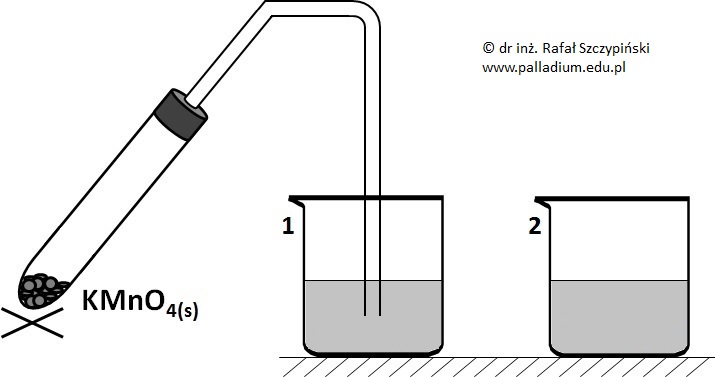
Podaj barwę uzyskanego w kolbie roztworu i napisz wzór sumaryczny oraz skróconą (względem poprzedzającego gazu szlachetnego) konfigurację elektronową jonu, którego obecność była przyczyną podanego przez Ciebie zabarwienia. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Przypisywanie nazw oraz wzorów półstrukturalnych alkanom oraz ich halogenopochodnym na podstawie cyklu syntez
Poniższy schemat przedstawia cykl syntez, których ostatecznym produktem jest alkan C, którego cząsteczki zawierają sześć grup metylowych oraz dwa IV-rzędowe atomy węgla.
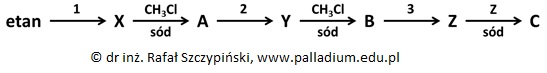
Związki chemiczne oznaczone na schemacie literami X, Y, Z to główne (uprzywilejowane) produkty reakcji monochlorowania odpowiednich spośród alkanów A i B oraz etanu. Reakcje, w których udział biorą związki X, Y, Z prowadzą do powstania mieszanin różnych związków organicznych, wśród których związki chemiczne A, B, C są pożądanymi produktami reakcji.
Podaj wzory półstrukturalne (grupowe) oraz nazwy systematyczne związków chemicznych A, B, C oraz X, Y, Z będących głównymi, bądź pożądanymi organicznymi produktami cyklu syntez przedstawionych na schemacie. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Bilansowanie równania reakcji redoks z udziałem roztworu zawierającego jony chromu
W kolbie wypełnionej argonem umieszczono blaszkę wykonaną z chromu. Do naczynia wprowadzono następnie nadmiar odpowietrzonego, 10% roztworu kwasu siarkowego(VI). Po zakończeniu przebiegu reakcji chemicznej uzyskany roztwór rozlano do dwóch zlewek i zmontowano układ zilustrowany rysunkiem:

Podczas prowadzenia opisanego rysunkiem doświadczenia roztwór w zlewce nr 1 zmienił swą barwę.
Napisz w formie jonowej skróconej równanie przebiegającej wówczas reakcji chemicznej. Zastosuj metodę bilansu jonowo-elektronowego. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone