Obliczanie masy azotanu(V) srebra, w celu przygotowania roztworu o określonym stężeniu procentowym i zawartości wody
Gęstość 40% roztworu azotanu(V) srebra w temperaturze 25 OC wynosi 1,48 g/cm3.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Oblicz masę AgNO3, jaką należy rozpuścić w 30 cm3 wody destylowanej, aby otrzymać roztwór o podanym w informacji wprowadzającej stężeniu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stopnia dysocjacji w roztworze wody amoniakalnej
W wyniku nasycania wody amoniakiem uzyskuje się roztwór zwany wodą amoniakalną. W celu przygotowania opisanego roztworu, odmierzono pewną objętość amoniaku, a następnie wprowadzono do naczynia zawierającego wodę destylowaną, uzyskując roztwór wody amoniakalnej o stężeniu równym 0,5 mol∙dm–3.
Oblicz, jaki procent cząsteczek amoniaku przekształca się w jony amonowe w roztworze o podanym w informacji wprowadzającej stężeniu molowym? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Porównanie stopni dysocjacji w wodnych roztworach związków chemicznych
W tabeli zamieszczono dane na temat wybranych wskaźników kwasowo-zasadowych:
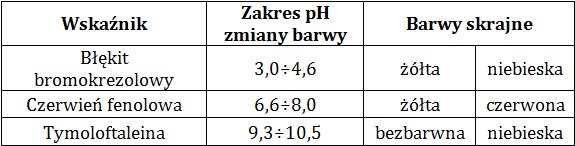
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
W trzech probówkach umieszczono kolejno po 5 cm3 wodnych roztworów związków chemicznych o stężeniach:
Ba(OH)2 2·10–4 mol·dm–3, HClO2 2·10–2 mol·dm–3 oraz HClO 2·10–4 mol·dm–3.
W wykropkowane pola wstaw odpowiedni znak („>”, „=” lub „<”), opisujący relację między wartościami stopnia dysocjacji (α) związków chemicznych w roztworach, których stężenia podano w informacji wprowadzającej. Ba(OH)2 ……… HClO Ba(OH)2 ……… HClO2 HClO ……… HClO2 © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Uszeregowanie roztworów elektrolitów według wzrastającego stopnia dysocjacji
W temperaturze 25 oC przygotowano wodne roztwory kilku związków chemicznych. Dane zebrano w tabeli:
HF o stężeniu 0,2 mol·dm–3
HClO2 o stężeniu 1 mol·dm–3
CH3COOH o stężeniu 0,05 mol·dm–3
(CH3)3N o stężeniu 0,08 mol·dm–3
HCOOH o stężeniu 3 mol·dm–3
C6H5COOH o stężeniu 0,001 mol·dm–3.
Uszereguj podane w informacji wstępnej roztwory według wzrastającego stopnia dysocjacji znajdujących się w nich związków chemicznych. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Stężenie cząsteczek niezdysocjowanych w roztworze kwasu fluorowodorowego
Roztwory kwasu fluorowodorowego są słabymi elektrolitami.
Oblicz stężenie molowe niezdysocjowanych cząsteczek fluorowodoru w jego wodnym roztworze o stężeniu równym 0,6 mol∙dm–3, jeśli stała równowagi procesu dysocjacji elektrolitycznej wynosi 6,3∙10–4. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie masy laktozy zawartej w mleku o określonej objętości oraz gęstości
Mleko jest układem stanowiącym mieszaninę różnych substancji chemicznych, a jego gęstość wynosi zwykle 1,03 g/cm3. Za nieco słodki smak odpowiada obecność znajdującej się w nim laktozy – dwucukru o wzorze sumarycznym C12H22O11, który w mleku krowim stanowi około 4,6% masy. W sprzyjających warunkach, w obecności odpowiednich bakterii laktoza zostaje przekształcona w kwas mlekowy:
C12H22O11 + H2O ⟶ 4C3H6O3
Oblicz masę laktozy znajdującej się w 2 litrach świeżego mleka. Wynik podaj w gramach, z dokładnością do trzech cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równania procesu autodysocjacji kwasu mrówkowego ze wskazaniem par kwas-zasada Brønsteda
W temperaturze 298 K bezwodny kwas mrówkowy (HCOOH) jest cieczą o gęstości 1,213 g∙cm–3. Związek ten ulega procesowi autodysocjacji, a jednym z jego produktów jest anion mrówczanowy. W temperaturze 298 K iloczyn jonowy kwasu mrówkowego ma wartość stałą i wynosi 6∙10–7.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Napisz równanie procesu autodysocjacji kwasu mrówkowego. Wskaż biorące w nim udział sprzężone pary kwas-zasada Brønsteda. W tym celu uzupełnij tabelę. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone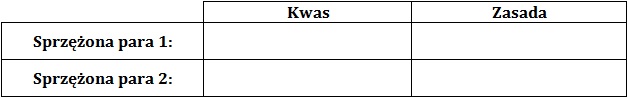
Obliczanie procentu cząsteczek kwasu mrówkowego ulegających autodysocjacji
W temperaturze 298 K bezwodny kwas mrówkowy (HCOOH) jest cieczą o gęstości 1,213 g∙cm–3. Związek ten ulega procesowi autodysocjacji, a jednym z jego produktów jest anion mrówczanowy. W temperaturze 298 K iloczyn jonowy kwasu mrówkowego ma wartość stałą i wynosi 6∙10–7.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
W laboratorium przechowywano 1 dm3 kwasu mrówkowego.
Oblicz, jaki procent cząsteczek tego związku chemicznego ulega procesowi autodysocjacji w temperaturze 298 K? Wynik podaj z dokładnością do czwartego miejsca po przecinku. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór drobiny będącej wyłącznie reduktorem
Poniżej przedstawiono zbiór wybranych indywiduów chemicznych:
Br2, Cl–, O22–, MnO4–, H+, Fe, Cr2+, SO32–, S2–, H2O2, NO2–, H2, F2.
Spośród wymienionych wyżej drobin wybierz te, które w procesie redoks mogą pełnić wyłącznie rolę reduktora. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór drobiny o kształcie piramidy trygonalnej oraz reakcja redoks z jej udziałem
Poniżej przedstawiono zbiór wybranych indywiduów chemicznych:
Br2, Cl–, O22–, MnO4–, H+, Fe, Cr2+, SO32–, S2–, H2O2, NO2–, H2, F2.
Jedna spośród wymienionych drobin ma kształt piramidy trygonalnej. Do zakwaszonego roztworu dwuchromianu(VI) potasu dodano wodny roztwór soli potasowej zawierający drobinę o podanym wyżej kształcie. Zawartość naczynia ogrzano i zaobserwowano dwie zmiany świadczące o przebiegu reakcji chemicznej.
Podaj spodziewane obserwacje i napisz w formie jonowej skróconej równanie przebiegającej reakcji chemicznej. Współczynniki uzgodnij stosując metodę bilansu jonowo-elektronowego. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór drobiny pochodzącej od pierwiastka o określonej konfiguracji elektronowej oraz reakcja redoks z jej udziałem
Poniżej przedstawiono zbiór wybranych indywiduów chemicznych:
Br2, Cl–, O22–, MnO4–, H+, Fe, Cr2+, SO32–, S2–, H2O2, NO2–, H2, F2.
W skład jednego z podanych anionów wchodzi pierwiastek, którego atomy w stanie podstawowym mają konfigurację elektronów walencyjnych w postaci: 4s23d5. W reakcji z mocnym kwasem, sól zawierająca drugi z anionów daje brunatny gaz o drażniącej woni.
Napisz w formie jonowej skróconej równanie reakcji chemicznej przebiegającej w środowisku kwasowym między wybranymi przez Ciebie, opisanymi wyżej dwoma jonami. Zastosuj metodę bilansu jonowo-elektronowego. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Opis obserwacji oraz uzasadnienie równaniem reakcji chemicznej z udziałem chlorku potasu oraz zakwaszonego roztworu manganianu(VII) potasu
Pewien student przeprowadził doświadczenie zilustrowane poniższym rysunkiem:
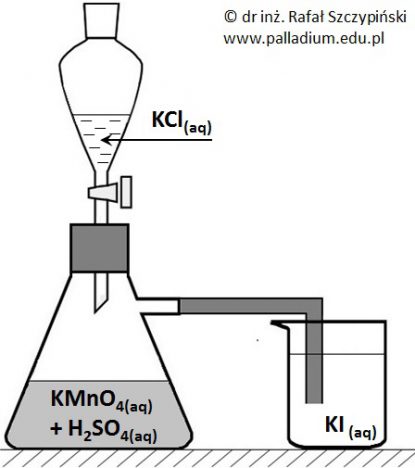
W celu wykonania tego eksperymentu zastosował stężone wodne roztwory soli oraz kwasu siarkowego(VI).
Napisz, co zaobserwowano w kolbie? Odpowiedź uzasadnij równaniem odpowiedniej reakcji chemicznej, zapisanym w formie jonowej skróconej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Opis barwy zawartości naczynia po wykonaniu doświadczenia z udziałem roztworu jodku potasu oraz uzasadnienie równaniem reakcji chemicznej
Pewien student przeprowadził doświadczenie zilustrowane poniższym rysunkiem:

W celu wykonania tego eksperymentu zastosował stężone wodne roztwory soli oraz kwasu siarkowego(VI). W trakcie doświadczenia obserwowano coraz to intensywniejsze zabarwienie znajdującego się w zlewce roztworu.
Napisz, jaką barwę przyjęła zawartość zlewki po zakończeniu doświadczenia? Odpowiedź uzasadnij równaniem przebiegającej reakcji chemicznej, zapisanym w formie jonowej skróconej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ocena poprawności sformułowanej tezy oraz uzasadnienie na podstawie przeprowadzonego eksperymentu
Pewien student przeprowadził doświadczenie zilustrowane poniższym rysunkiem:

W celu wykonania tego eksperymentu zastosował stężone wodne roztwory soli oraz kwasu siarkowego(VI).
Po zakończeniu doświadczenia, student sformułował dwa wnioski oraz jedną tezę.
Wniosek 1: anion manganianowy(VII) zdolny jest do utlenienia anionu chlorkowego.
Wniosek 2: chlor jest silniejszym utleniaczem od jodu.
Teza: anion manganianowy(VII) zdolny jest do utlenienia anionu jodkowego.
Czy teza postawiona przez studenta jest prawdziwa? Uzasadnij swoje stanowisko. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone

