Opis obserwacji dotyczących doświadczenia z udziałem roztworu siarczanu(VI) miedzi(II), siarczanu(VI) amonu oraz wodorotlenku sodu
Wodorotlenki trudno rozpuszczalne w wodzie można otrzymać na kilka sposobów. Zwykle są to reakcje przebiegające w wyniku zmieszania wodnych roztworów soli i mocnej zasady lub soli i wody amoniakalnej. W przypadku drugiego z wymienionych procesów wiele otrzymanych w ten sposób wodorotlenków metali bloku d ulega dalszej reakcji z nadmiarem dodawanego odczynnika strącającego, tworząc w ten sposób związki kompleksowe. W jonie kompleksowym atom centralny często przyjmuje liczbę koordynacyjną o wartości dwukrotnie większej od wartości ładunku jonów tego metalu, jaki miał w soli użytej do reakcji.
Przeprowadzono doświadczenie chemiczne, którego schemat zilustrowano poniższym rysunkiem. Podczas wkraplania roztworu NaOH zawartość umieszczonej na mieszadle magnetycznym kolby bardzo ostrożnie ogrzewano.
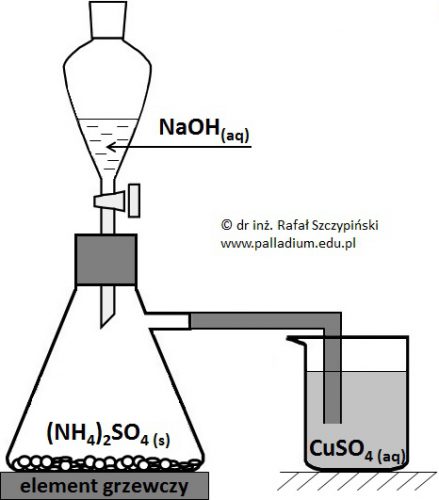
Opisz obserwacje jakie odnotowano w zlewce, jeśli zastosowano nadmiar roztworu wodorotlenku sodu oraz siarczanu(VI) amonu względem siarczanu(VI) miedzi(II). Odpowiedź uzasadnij za pomocą równań odpowiednich reakcji chemicznych, zapisanych w formie jonowej skróconej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Otrzymywanie trudno rozpuszczalnego wodorotlenku ze związku kompleksowego oraz jego roztwarzanie
Wodorotlenki trudno rozpuszczalne w wodzie można otrzymać w reakcji roztworów niektórych związków kompleksowych z kwasami. Przykładem może być działanie kwasem solnym na wodny roztwór tetrahydroksocynkanu potasu. Stosując nadmiar roztworu kwasu spowodujemy dalszy przebieg reakcji chemicznej, co poskutkuje roztworzeniem się osadu powstałego wodorotlenku.
Napisz w formie jonowej skróconej równanie przebiegającej reakcji strąceniowej oraz równanie reakcji roztwarzania powstałego osadu. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ocena poprawności stwierdzeń dotyczących reakcji z roztworem związku kompleksowego cynku
Wodorotlenki trudno rozpuszczalne w wodzie można otrzymać w reakcji roztworów niektórych związków kompleksowych z kwasami. Przykładem może być działanie kwasem solnym na wodny roztwór tetrahydroksocynkanu potasu. Stosując nadmiar roztworu kwasu spowodujemy dalszy przebieg reakcji chemicznej, co poskutkuje roztworzeniem się osadu powstałego wodorotlenku.
Oceń poprawność poniższych zdań wpisując literę „P” (prawda) lub literę „F” (fałsz). 1. Podczas reakcji roztworu związku kompleksowego z kwasem wartość pH układu reakcyjnego nie zmienia się. 2. W wyniku opisanego procesu cynk zmienia swój stopień utlenienia. 3. Zwiększając stopniowo pH roztworu zawierającego jony Zn2+ można otrzymać roztwór związku kompleksowego zawierającego cynk. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie barwy roztworu uzyskanego po wprowadzeniu gazowego chlorowodoru do wody w obecności oranżu metylowego
Do 1 dm3 wody zawierającej dodatek kilku kropli roztworu oranżu metylowego wprowadzono 560 cm3 chlorowodoru (odmierzonego w warunkach normalnych) i zaobserwowano zmianę zabarwienia zawartości naczynia. Następnie do uzyskanego roztworu wprowadzono 962 mg wapna gaszonego i energicznie wstrząśnięto zawartością naczynia reakcyjnego.
Określ barwę roztworu uzyskanego po wprowadzeniu chlorowodoru do opisanego wodnego roztworu zawierającego oranż metylowy. Odpowiedź uzasadnij równaniem odpowiedniego procesu zapisanym w formie jonowej skróconej. Barwa roztworu: Równanie procesu: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Opis obserwacji podczas wprowadzenia wapna gaszonego do kwasu solnego w obecności oranżu metylowego
Do 1 dm3 wody zawierającej dodatek kilku kropli roztworu oranżu metylowego wprowadzono 560 cm3 chlorowodoru (odmierzonego w warunkach normalnych) i zaobserwowano zmianę zabarwienia zawartości naczynia. Następnie do uzyskanego roztworu wprowadzono 962 mg wapna gaszonego i energicznie wstrząśnięto zawartością naczynia reakcyjnego.
Wykonaj niezbędne obliczenia i napisz, co zaobserwowano po wprowadzeniu wapna gaszonego do opisanego roztworu kwasu solnego oraz jaki był odczyn docelowego roztworu? Obserwacje: Odczyn roztworu: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone